研究材料
人结直肠癌肝转移组织标本;结肠直肠癌细胞系;小鼠
技术路线
步骤1:贝伐单抗耐药的CRCLM异种移植模型中血管选定的数量和FAPα蛋白的表达水平
步骤2:条件性敲除HSCs中FAPα基后探究影响血管选定过程原因
步骤3:研究FAPα对MDSC的招募和肿瘤转移的影响
步骤4:探究FAPα促进血管选定的分子机制
步骤5:阐明结直肠癌肝转移患者贝伐单抗耐药的分子机制
结果部分:
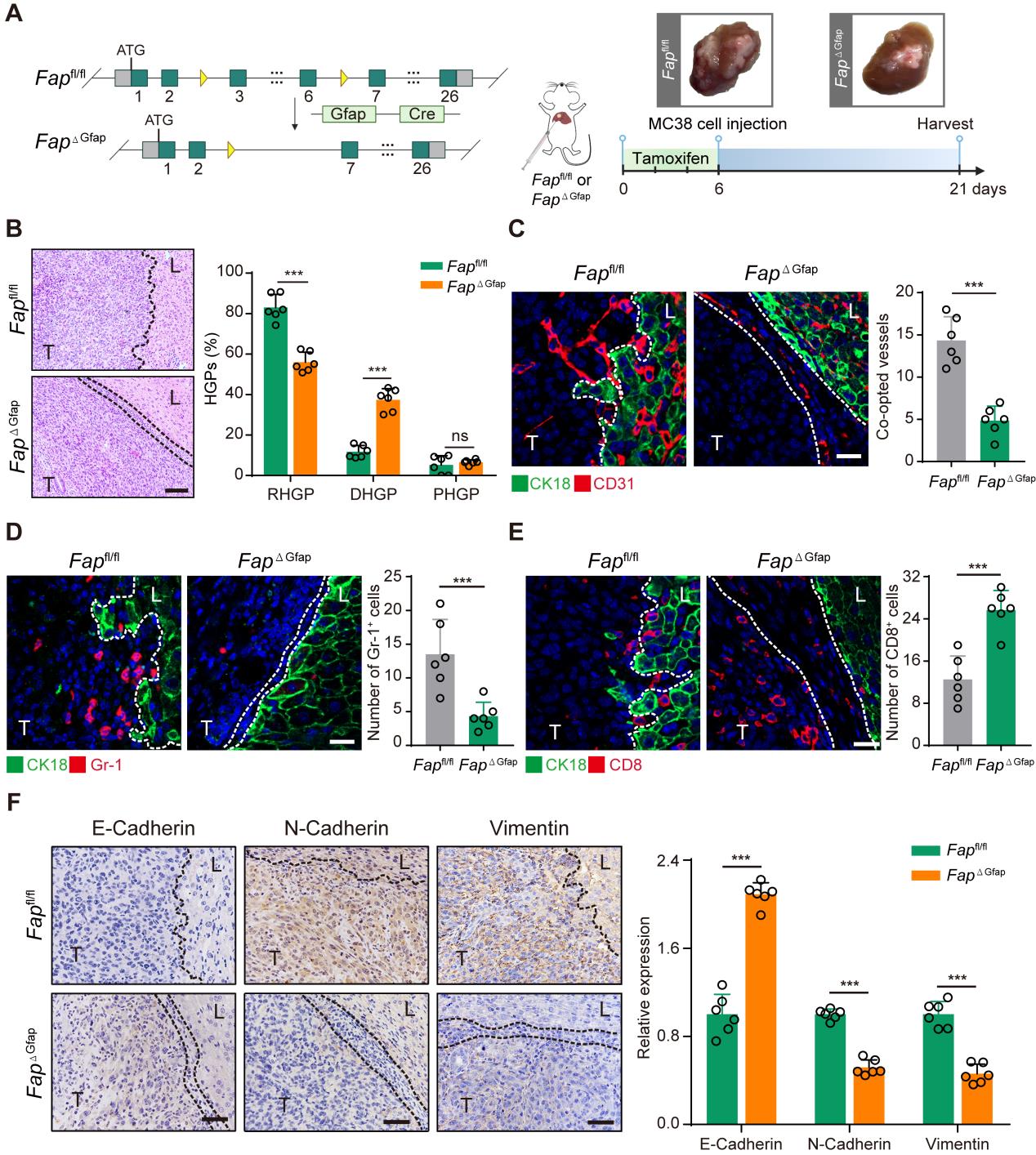
- 贝伐单抗耐药的CRCLM异种移植模型中血管选定的数量和HSCs中FAPα基因的表达水平均升高
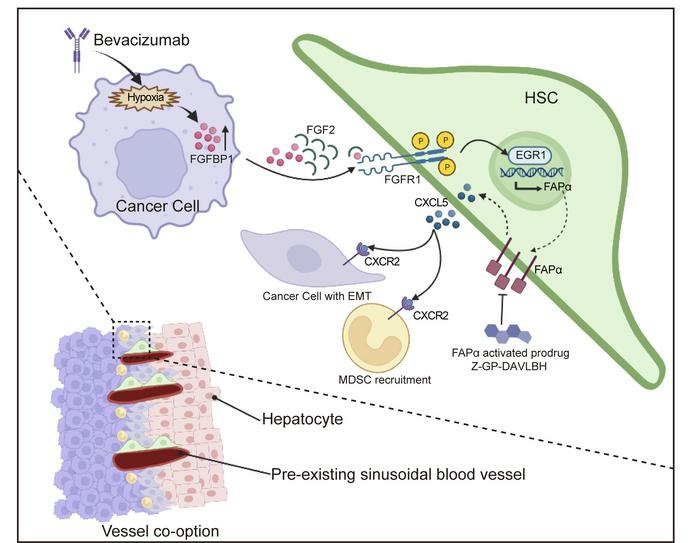
研究者通过异种移植贝伐单抗敏感的HCT116细胞到小鼠肝脏,然后使用10mg/kg的贝伐单抗处理42天产生耐药模型,使用贝伐单抗耐药的细胞HT-29作为对照组(Fig1 A)。结果发现,在贝伐单抗耐药组的病理学生长模式以RHGP为主要模式(Fig1 B),并且免疫荧光结果显示贝伐单抗获得性耐药的HCT116 CRCLM异种移植模型中发生血管选定(CD31+)的数量更多(Fig1 C)。通过进一步针对贝伐单抗耐药组中出现血管选定的血管特征进行分析发现,FAPα蛋白主要在αSMA+ HSCs表达,而在对照组中无表达(Fig1 D)。这些结果提示结直肠癌肝转移中血管选定导致贝伐单抗耐药可能与HSCs中FAPα的表达有关。
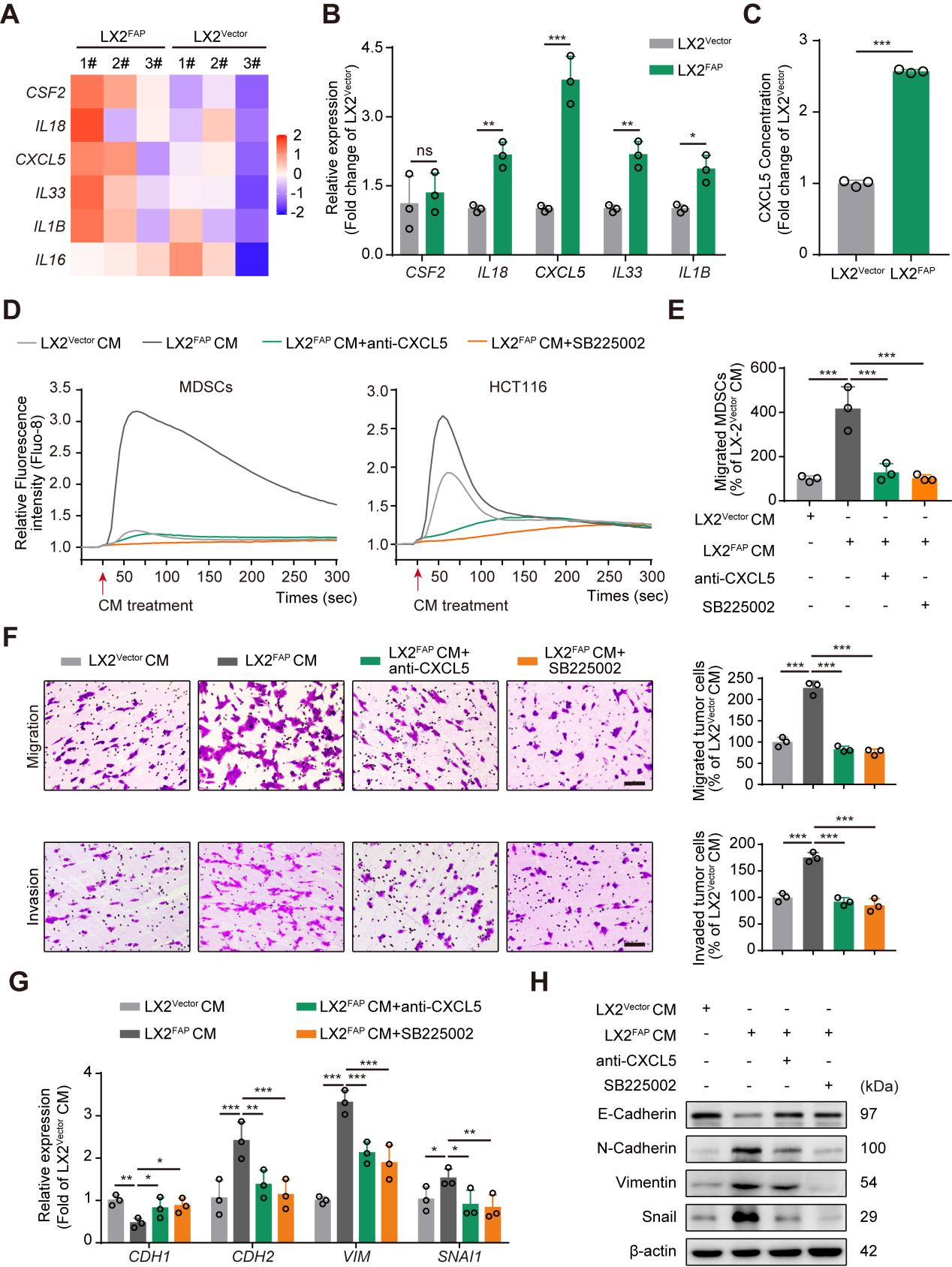
- FAPα诱导HSCs分泌CXCL5促进血管选定
研究者接下来探索了FAPα在HSCs中对血管选定的作用。结果显示,FAPα条件性敲除后血管选定的数量减少(Fig2 C),GR-1+髓源性抑制性细胞的募集明显受到抑制(Fig2 D),CD8+T细胞的数量明显升高(Fig2 E),FAPα条件性敲除后RT-PCR结果显示间充质细胞标志蛋白vimentin和N-cadherin的表达水平显著下调,上皮细胞标志蛋白E-cadherin显著上调,因此推测FAPα+HSCs可能是通过预先建立免疫抑制生态位,诱导肿瘤细胞EMT促进血管选定。
转录组测序结果显示,FAPα基因过表达的肝星状细胞系中分泌的细胞因子CSF2, IL18, CXCL5, IL33, IL1B以及 IL16的表达水平上调(Fig3 A),并且通过RT-PCR对上述基因进行验证,结果显示IL18,CXCL5, IL33和IL1B与测序结果相符,并且CXCL5基因的表达水平升高的最为显著(Fig3 B);ELISA结果显示在FAPα基因过表达的细胞系的培养基上清中CXCL5的含量也升高(Fig3 C);结果提示FAPα可能与HSCs分泌CXCL5有关。因为肿瘤来源的CXCL5能够通过激活CXCR2促进肿瘤细胞EMT和MDSC募集,因此研究者推测HSCs来源的FAPα可能通过CXCL5-CXCR2轴促进肿瘤细胞EMT和MDSC的募集,并最终通过一系列实验验证了猜想:FAPα诱导HSCs分泌CXCL5细胞因子激活CXCR2促进肿瘤细胞EMT和MDSC募集,从而促进血管选定。
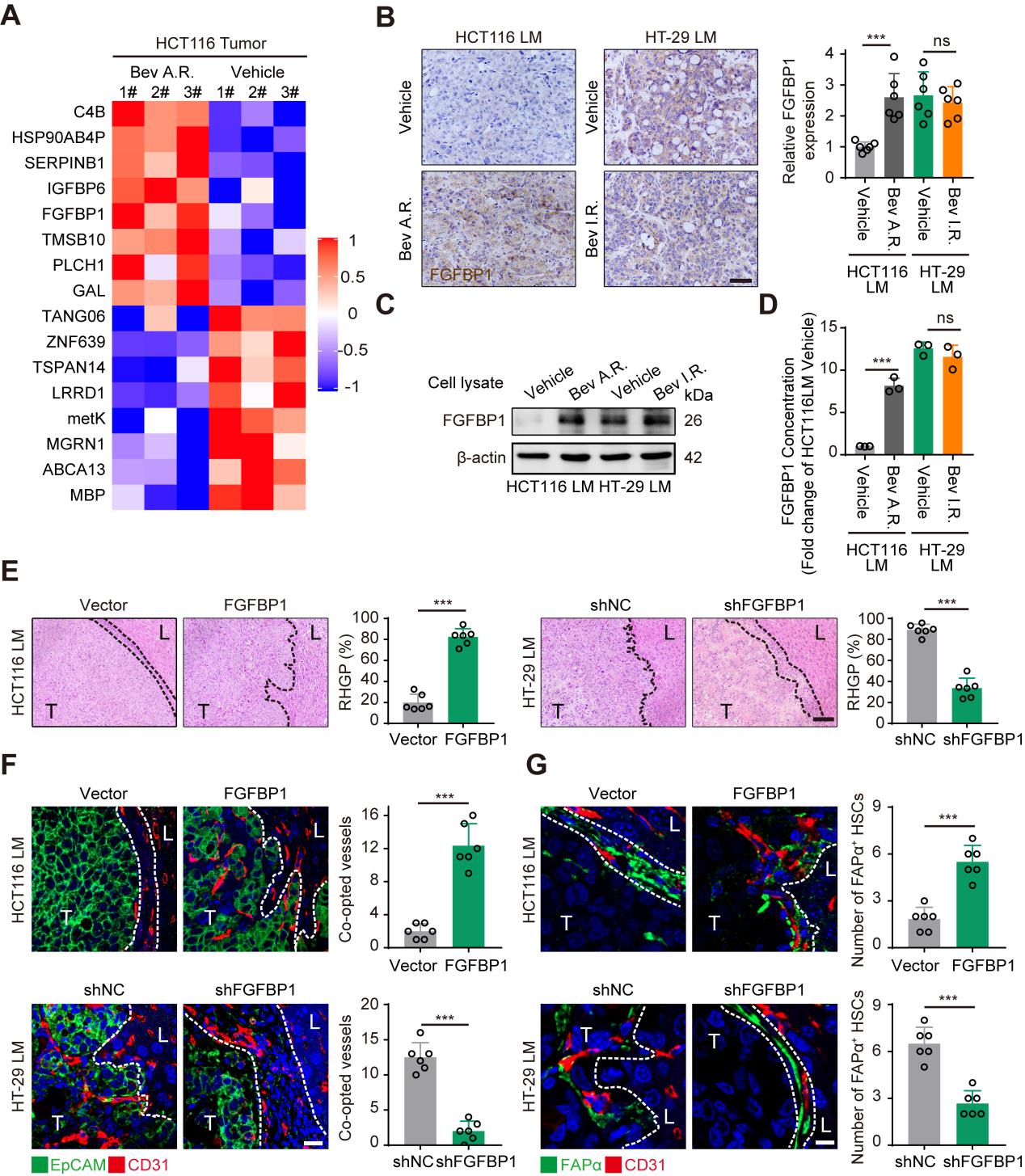
3.肿瘤细胞源性FGFBP1能够诱导HSCs表达FAPα促进血管选定
为探讨HSCs表达FAPα促进血管选定的分子机制,研究者运用蛋白质组学方法对贝伐株单抗敏感和耐药的HCT116 CRCLM异种移植肿瘤进行了分析,结果显示在贝伐单抗耐药的肿瘤中检测到17个上调表达的蛋白(Fig4 A),并且通过RT-PCR确认FGFBP1基因表达水平也最为显著(SFig4 A&B)。免疫组化染色、Western blotting和ELISA检测显示,在贝伐单抗耐药的CRCLM异种移植体系(HCT116和HT-29)的肿瘤组织和原代细胞中FGFBP1均高表达(Fig4 B-D)。为探讨FGFBP1对HSCs中FAPα表达和血管选定的作用机制,在HCT116细胞上构建了FGFBP1基因过表达细胞系,在HT-29细胞上构建了FGFBP1基因干扰表达细胞系,HE染色结果显示过表达FGFBP1后RHGP的比率显著升高,相反,干扰FGFBP1的表达之后RHGP的比率显著降低(Fig4 E)。同时,在免疫荧光结果中过表达FGFBP1后血管选定的数量和阳性表达FAPα蛋白的HSCs数量也显著增多,干扰之后数量就会减少(Fig4 F,G)。
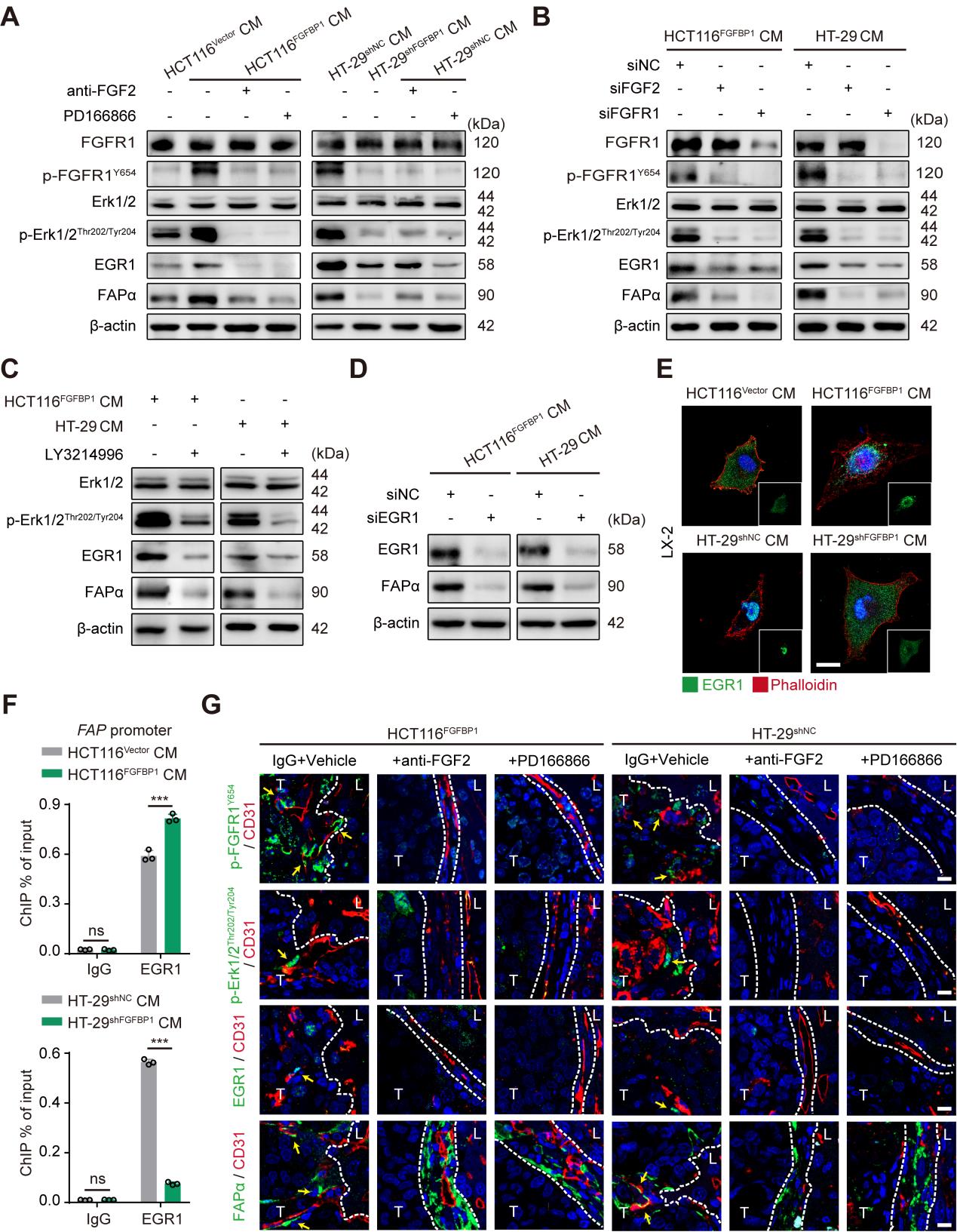
4、FGFBP1能够通过FGF2-FGFR1-ERK1/2-EGR1轴诱导HSCs表达FAPα蛋白
接下来,研究者针对FGFBP1诱导HSCs表达FAPα蛋白的机制展开探索,由于FGFBP1能够通过细胞外基质(ECM)释放FGF2来增强FGFR1信号通路,所以研究者检测了LX-2细胞系中FGF2和FGFR1的基因表达水平,发现其确实高于其他的FGFs和FGFRs(sFig6 A,B)。另外,FGF2和磷酸化的FGFR1在阳性表达FAPα蛋白的HSCs中表达水平升高(sFig6 C),说明FGFBP1可能是通过FGF2-FGFR1信号通路来诱导HSCs表达FAPα蛋白的。鉴于ERK1/2-EGR1轴位于FGFR1的下游,而EGR1能够与FAP基因的启动子结合诱导FAPα的表达,所以研究者认为FGFR1激活诱导HSCs中FAPα的表达可能受ERK1/2-ERG1轴的调控。因此研究者就通过WB检测了FGFR1和ERK1/2的磷酸化状态以及EGR1和FAPα的表达水平,发现FGFBP1过表达之后这些标志蛋白的表达水平均显著上调(Fig5 A)。此外,敲除RGR1基因后FAPα的表达水平显著下调(Fig5 D),进一步对研究的猜想进行了验证。
紧接着,研究者通过一系列的细胞培养和分子生物学方法,进一步探究了FGF2-FGFR1-FAPα途径在促进贝伐单抗诱导的血管选定的作用后发现,FGFR1的激活可能是依赖于FAPα诱导HSCs分泌趋化因子CXCL5促进肿瘤细胞的EMT和MDSC招募,从而促进血管选定过程。并且这一结果也在临床结直肠癌肝转移的标本中进行了验证,此外,该研究的最后使用了研究者实验室合成FAPα活化的前体药物Z-GP-DAVLBH,数据表明Z-gp-DAVLBH能选择性诱导FAPα+HSCs细胞凋亡,扰乱血管选定,克服血管选定介导的贝伐单抗单抗治疗耐药。
总结
本文通过运用转录组学和蛋白质组学技术进行前期数据探索性挖掘,并结合细胞和分子生物学技术揭示了贝伐单抗耐药的肿瘤细胞高表达FGFBP1 ,并通过FGFBP1-FGF2-FGFR1-ERK1/2-EGR1通路诱导HSCs中FAPα蛋白的表达,FAPα进而促进HSCs中CXCL5的分泌后激活CXCR2来增强MDSC的浸润和肿瘤细胞EMT,最终促进血管选定。此外,用FAPα激活的前药物Z-GP-DAVLBH靶向FAPα+HSCs有效地克服了血管选定介导的CRCLM对抗血管生成治疗的耐药性,提供了潜在的治疗策略和药物候选。