
肥胖的代谢性炎症特征就是促炎性巨噬细胞浸润脂肪组织。在肥胖组织中,M1巨噬细胞可能占总脂肪细胞的50%,会引起胰岛素抵抗、代谢功能障碍以及全身炎症(元炎症)状态。
真核生物翻译起始因子5A(elF5A)是目前已知的唯一一种在保守赖氨酸残基处进行翻译后修饰生成罕见氨基酸Hyp的蛋白。DHPS(deoxyhypusine synthase)催化eIF5A生成的eIF5AHyp可以控制参与炎症的mRNA的翻译,但DHPS及eIF5AHyp在肥胖代谢炎症发生过程中的作用仍未阐明。
2021年9月,来自美国印第安纳大学的Carmella Evans-Molina团队和芝加哥大学的Raghavendra G. Mirmira团队合作在Cell Metabolism(IF 27.3)上发表题为“Deoxyhypusine synthase promotes a pro-inflammatory macrophage phenotype”的研究文章,该研究借助蛋白质组学和转录组学揭示了DHPS通过eIF5AHyp参与巨噬细胞中炎症调控和趋化性的mRNA亚群的转录后调控,阻断DHPS可减少炎症,改善胰岛素敏感性和葡萄糖稳态。

研究材料
C57BL/6J小鼠的骨髓衍生巨噬细胞 (BMDM)
骨髓特异性Dhps敲除小鼠
RAW 264.7小鼠巨噬细胞系
斑马鱼
技术路线
步骤1:肥胖小鼠脂肪组织中DHPS和eIF5AHyp水平检测;
步骤2:研究DHPS和eIF5AHyp对促炎型巨噬细胞M1的调控作用;
步骤3:蛋白组学分析:探讨DHPS对M1巨噬细胞炎症信号的转录后调控;
步骤4:转录组学分析:揭示DHPS 对M1巨噬细胞转录水平的影响;
步骤5:DHPS对M1巨噬细胞在炎症过程中浸润到脂肪组织中的调控作用。
研究结果
1. 肥胖小鼠脂肪组织巨噬细胞中DHPS和eIF5AHyp水平升高
为了评估DHPS和eIF5AHyp水平的变化是否与肥胖和脂肪组织炎症相关,研究人员从低脂饮食(LFD)或高脂饮食(HFD)的C57BL/6J小鼠附睾脂肪组织的基质血管部分(SVF)中分离出免疫细胞,通过多色流式细胞术和免疫印迹分析发现高脂饮食会增加SVF中促炎(M1样)巨噬细胞的占比,以及巨噬细胞中eIF5AHyp的含量。为了阐明DHPS在巨噬细胞表型中的作用,作者使用来自C57BL/6J小鼠的骨髓衍生巨噬细胞(BMDM)进行了体外研究。结果显示,BMDM的 M1巨噬细胞极化后,DHPS和eIF5AHyp水平增加。而DHPS的小分子抑制剂Gc7处理却可导致促炎巨噬细胞的剂量依赖性降低,eIF5AHyp水平也同样降低。
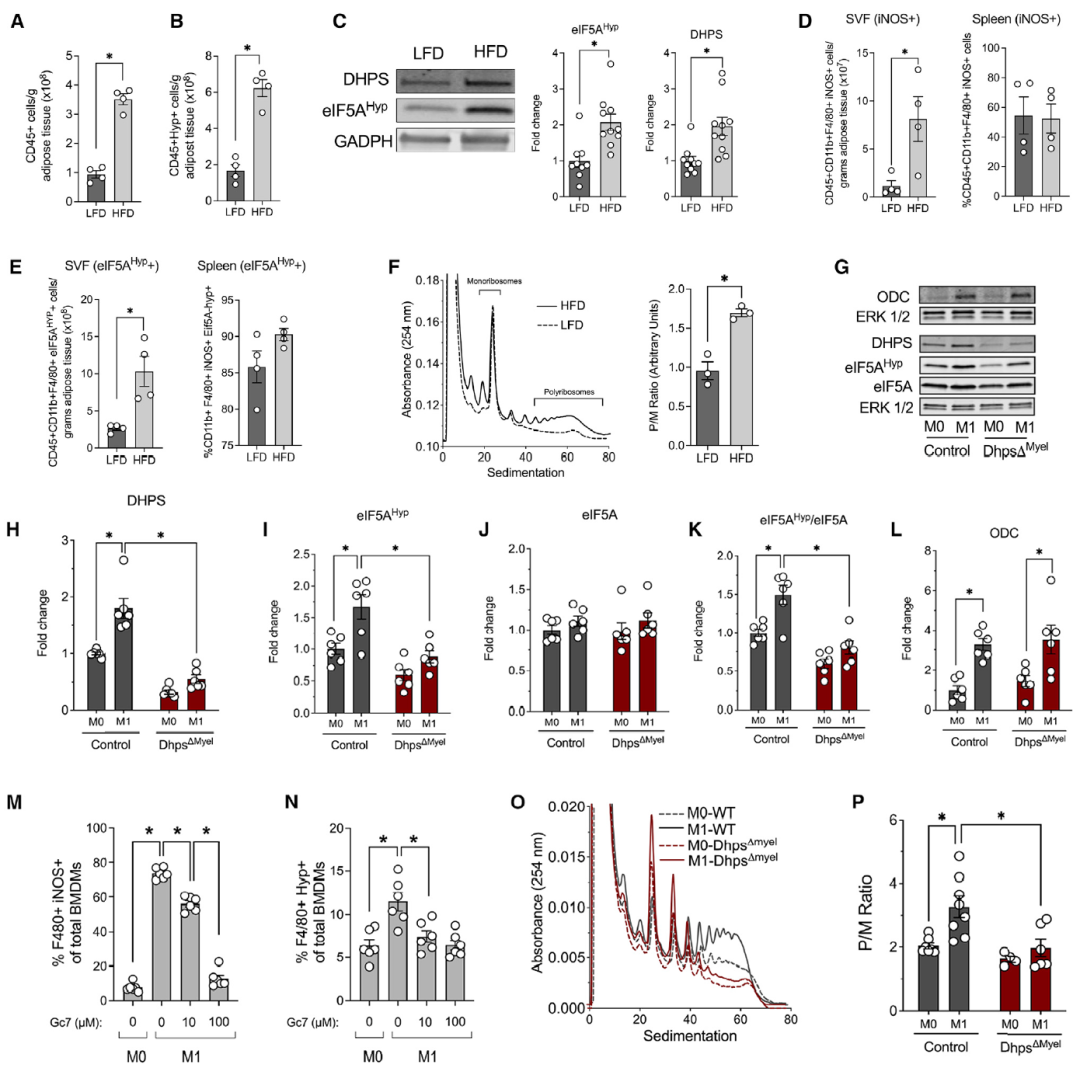
图1 促炎性M1样巨噬细胞表型依赖于DHPS
2. DHPS 控制巨噬细胞的mRNA翻译和细胞迁移
在髓系特异性Dhps敲除小鼠(DhpsΔMyel) BMDM中,DHPS和eIF5AHyp水平降低。通过多聚核糖体分析,观察到DHPS不足会导致与M1极化的BMDM多聚核糖体相关联的总RNA降低,mRNA翻译起始减少,表明DHPS不足会引发翻译起始阻滞。作者在斑马鱼中进行了尾鳍损伤试验,尾鳍损伤导致巨噬细胞6小时内迁移到损伤部位增加,用DHPS抑制剂处理则会导致迁移到损伤部位的巨噬细胞数量显着减少。这些结果表明抑制DHPS会较少巨噬细胞迁移。
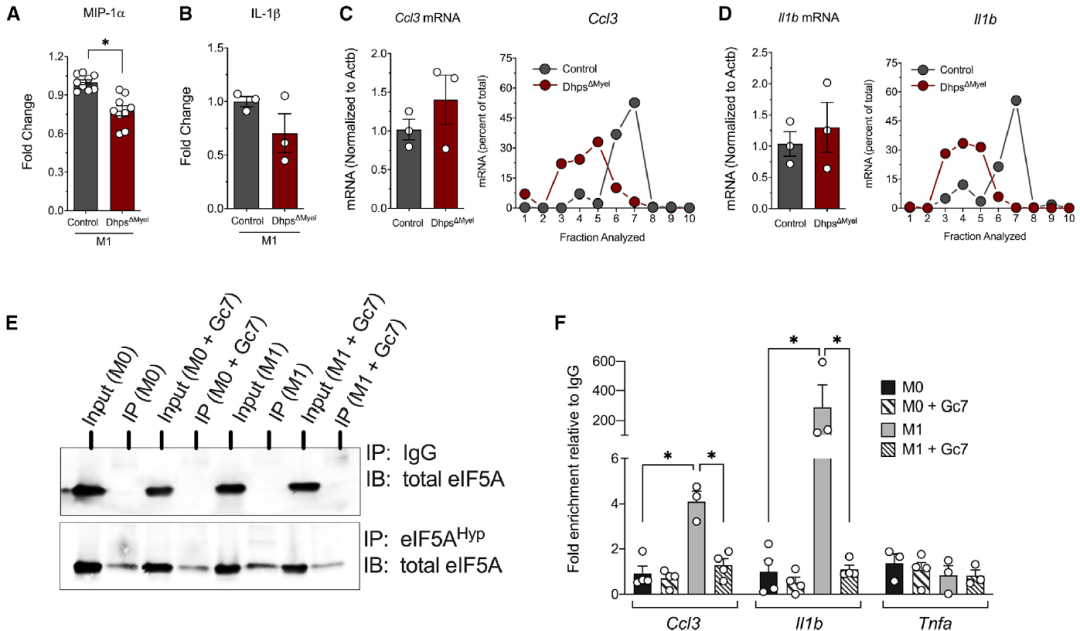
图2 eIF5AHyp调控mRNA翻译起始
3. DHPS促进M1巨噬细胞炎症信号的转录后调控
研究者对Control小鼠和Dhps敲除小鼠的骨髓源性巨噬细胞 (BMDM) M0、M1、M2进行TMT蛋白质组学分析,发现在DhpsΔMyel巨噬细胞中显著变化的有111种蛋白质。KEGG 通路分析表明,差异蛋白聚集在一氧化氮信号 (cGMP-PKG)通路中、感染/炎症通路和代谢炎症(脂肪细胞因子信号)通路,这些途径都与DHPS促进M1巨噬细胞极化的作用相关。
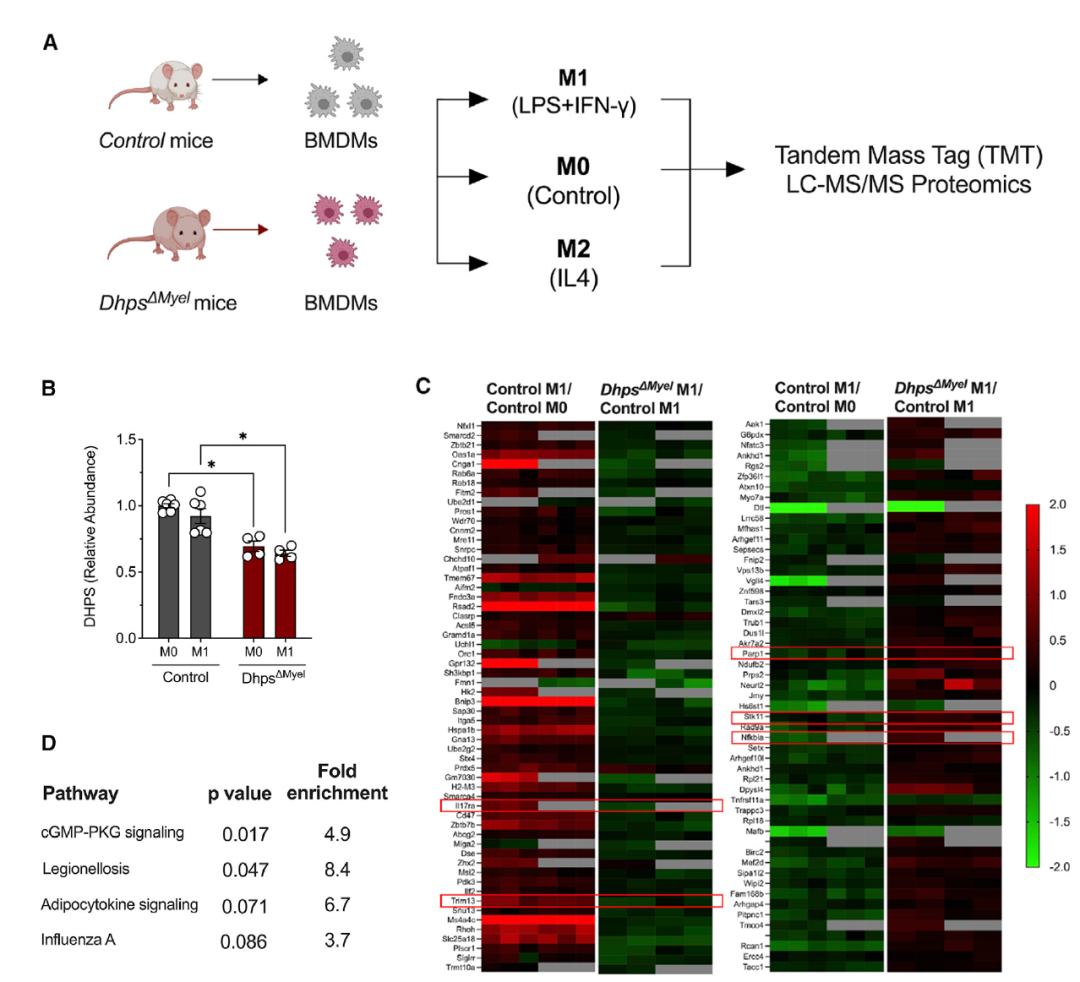
图3 Dhps缺失的M1巨噬细胞蛋白质组学特征
4. DHPS 影响M1巨噬细胞炎症信号的转录
进一步通过转录组学分析发现,Dhps缺乏导致M1巨噬细胞NF-κB 靶标基因Tlr2、Fcgr3、Il-27、Ccl2、Fcgr1、Cxcl1和Ptges的表达降低,诱导了与抗炎和组织修复反应相关的基因Col1a2、Timp3和Fstl1的表达。上述结果表明,DhpsΔMyel BMDMs 在M1 极化条件下基因表达谱发生改变,倾向于下调 NF-κB 靶标和上调抗炎特征。此外,转录组和蛋白组学联合分析发现仅有7个基因在转录和蛋白层面变化一致,这些数据显示DhpsΔMyel巨噬细胞蛋白质的改变可能发生在转录水平改变后。
5. DHPS 调控M1巨噬细胞浸润脂肪组织
为了测试DHPS在肥胖诱导的代谢炎症和葡萄糖耐受不良中的作用,对DhpsΔMyel小鼠和同窝对照小鼠喂食LFD或HFD 5周。与喂食LFD的小鼠相比,喂食HFD的DhpsΔMyel小鼠脂肪组织中的巨噬细胞总数没有差异,但M1巨噬细胞比例显著降低,在腹腔注射葡萄糖后也表现更好的葡萄糖耐受性。
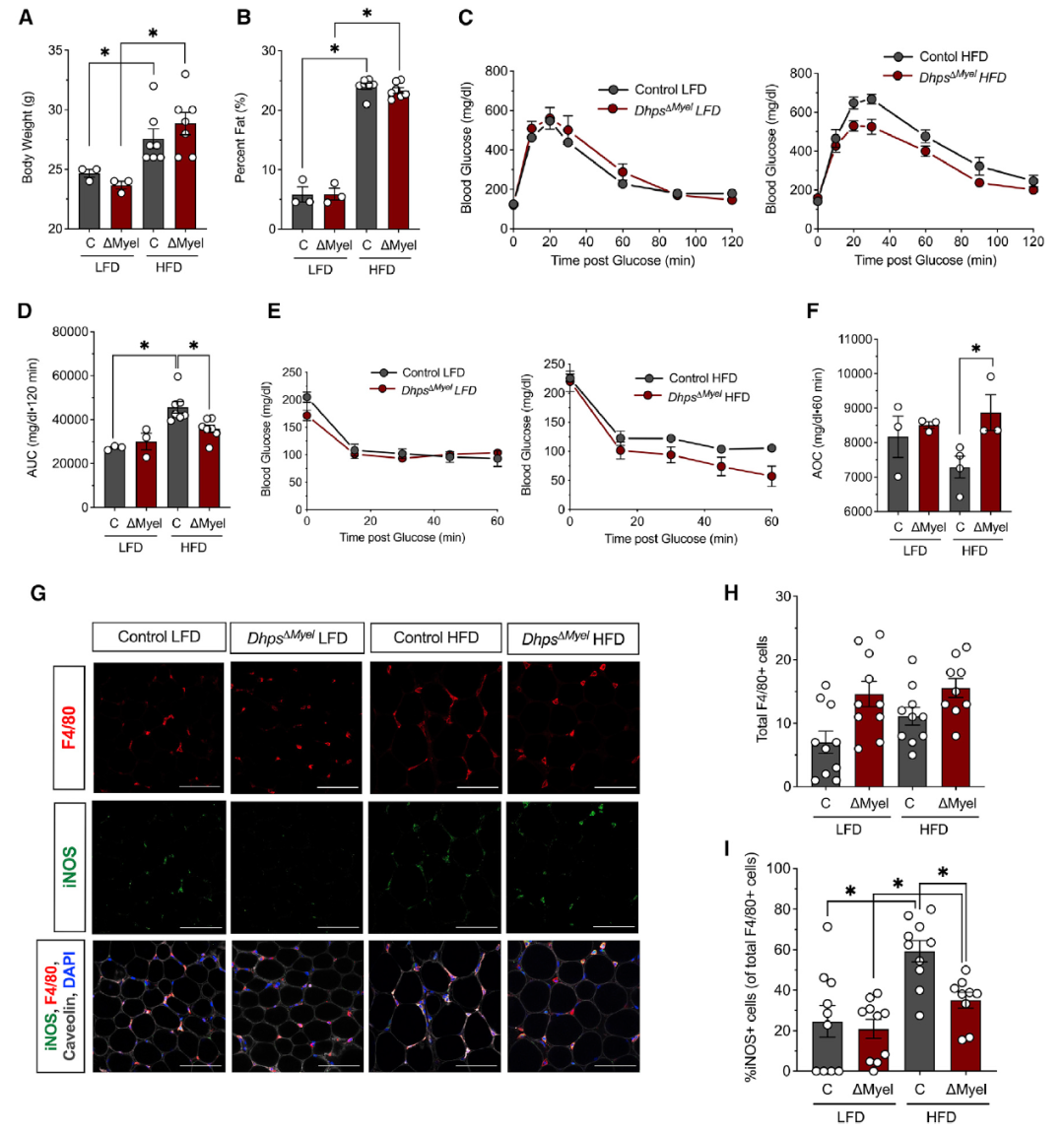
图4 Dhps缺失会减少脂肪组织中M1巨噬细胞的积累并改善葡萄糖耐受性
小结
本研究借助蛋白质组学和转录组学,揭示了肥胖中DHPS通过修饰翻译因子eIF5AHyp促进巨噬细胞中控制炎症的mRNA的转录后调节,进而通过NF-kB信号促进促炎症表型M1的极化,最后实现脂肪组织代谢性炎症减轻、调控葡萄糖稳态的目的。本研究加深了我们对于肥胖过程中巨噬细胞调控炎症发生过程的理解,揭示了调控巨噬细胞活化的关键靶点——DHPS/eIF5AHyp。
中科优品推荐
【中科新生命】建立了完整的多组学服务平台,帮助老师从基因组、转录组、蛋白组、修饰组、代谢组等多组学角度系统地解析数据,挖掘关键生物学信息。欢迎感兴趣的老师前来咨询。


