哺乳动物的肥大细胞来源于胚胎起源的造血细胞和成年骨髓,它可通过各种受体识别免疫、炎症和环境变化,包括高亲和力IgE受体(FcεRI),G蛋白偶联受体(例如C3a受体)或离子通道(例如,P2X7R)等。当受到外界刺激后,肥大细胞可以迅速释放预先形成的细胞质颗粒,其中包含组胺,蛋白聚糖(特别是肝素)、蛋白酶,以及白三烯、前列腺素和细胞因子。肥大细胞产物具有广泛的生物学活性,包括促进局部炎症,增强血管通透性和刺激周围神经,导致诸如瘙痒,打喷嚏和**等症状。但是,肥大细胞除引起过敏反应以外的生理或病理功能仍不清楚。
为阐明肥大细胞主要功能的结构基础,德国癌症研究中心Hans-Reimer Rodewald研究组2020年2月11日在Immunity(IF = 21.522)上在线发表题为 Human Mast Cell Proteome Reveals Unique Lineage, Putative Functions, and Structural Basis for Cell Ablation 的研究论文,利用蛋白质组学揭示人类肥大细胞的独特谱系、功能和结构基础。
研究结果:
人结缔组织肥大细胞的蛋白组学特征
作者首先从人皮肤和脂肪组织中分选出肥大细胞,并检测了分选效率;为了比较分析,作者还从外周血中提取了单核细胞(PBMC)。作者对9种细胞样本(皮肤肥大细胞3群、脂肪肥大细胞3群、三个供体来源的PBMC)进行蛋白质提取,利用基于准等重二甲基化标记的高通量蛋白质组学技术进行分析,从中筛选出3253个可定量的蛋白质。
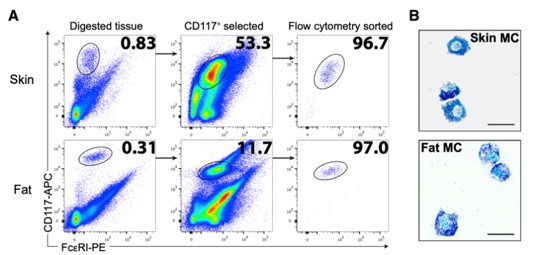
作者进一步对肥大细胞特异性表达的蛋白质进行筛选。与PBMC相比,皮肤肥大细胞中有471个蛋白显著上调;脂肪肥大细胞中有517个蛋白显著上调。其中,胰蛋白酶(TPSAB1)、羧肽酶A3(CPA3),羧肽酶M(CPM),糜酶1(CMA1)和组织蛋白酶G(CTSG)、造血前列腺素D合酶(HPGDS)以及受体酪氨酸激酶CD117(KIT)和CD203c(也称为ENPP3)在皮肤和脂肪肥大细胞中特异性表达。进一步作者比较了不同来源的肥大细胞,发现仅有11中蛋白质存在差异,反映了组织微环境对结缔组织肥大细胞中蛋白质的影响有限。
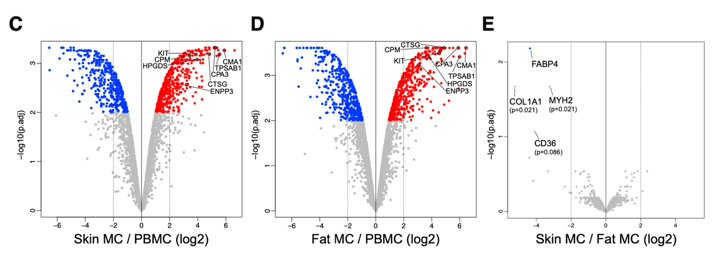
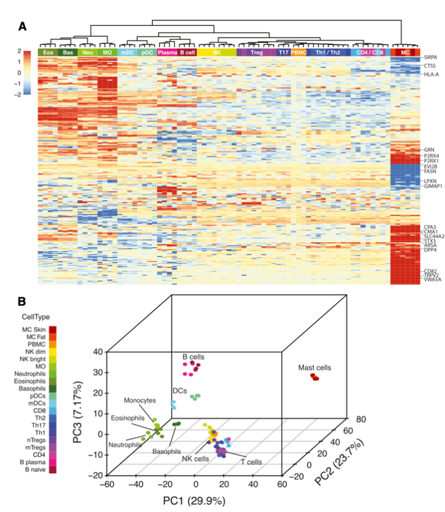
为更好地定义人类肥大细胞与造血系统其他谱系的关系,我们对蛋白质组数据与最近发布的血液来源免疫细胞的蛋白质组数据集进行了比较。首先,作者对两组数据合并,从中取top 15%可变蛋白进行层次聚类。结果显示两种肥大细胞类型与淋巴和髓样免疫细胞出现了分离,原因是由于肥大细胞谱系中出现的肥大细胞特征性蛋白(例如CD82,TRPV2和SLC44A2)的高表达和循环淋巴和髓样免疫细胞谱系的蛋白的低表达(例如,组织蛋白酶S [CTSS],信号调节蛋白α-1[SIRPA]和嗜温病毒整合位点2B蛋白同源物[EVI2B])。
进一步分析发现,这两个肥大细胞子集彼此最接近。在骨髓细胞中,肥大细胞最接近嗜碱性粒细胞;然而,总的肥大细胞与所有粒细胞(嗜中性粒细胞,嗜酸性粒细胞和嗜碱性粒细胞)的关系非常远。鉴于粒细胞谱系和肥大细胞具有相似的功能特性(如脱粒和蛋白酶释放),这种相似性的缺乏可能令人惊讶。
小鼠结缔组织肥大细胞的蛋白组学特征
作者进一步从小鼠腹膜渗出细胞(PEC)中纯化了结缔组织型肥大细胞,并检测了分选效率;为了比较分析,作者选择了肥大细胞野生型(Cpa3 + / +)或肥大细胞缺乏型(Cpa3cre / +)小鼠的PEC。作者对9种鼠类细胞样本(来自于纯化的腹膜肥大细胞,Cpa3 + / + PEC和Cpa3cre / + PEC)进行蛋白组学分析,从中筛选出3,611个可定量蛋白质。
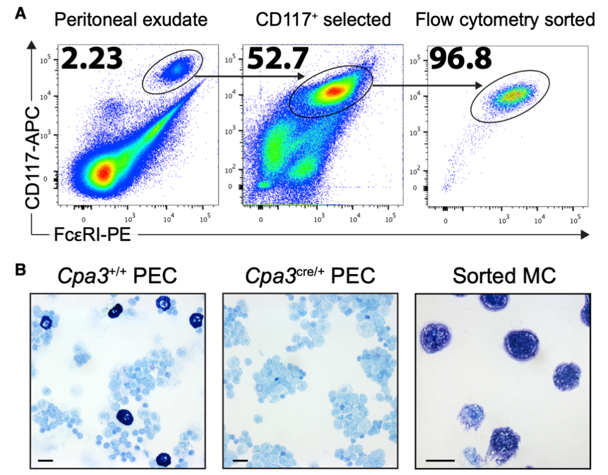
作者接下来将分选的肥大细胞与肥大细胞缺乏的Cpa3cre / +小鼠的PEC进行了比较,发现90种蛋白质在肥大细胞中高表达(相比PECs)。其中,小鼠肥大细胞标记蛋白显著上调,如羧肽酶A3(CPA3),肥大细胞蛋白酶4(MCPT4)和糜酶1(CMA1)。此外,我们还筛选出人类典型的肥大细胞标志蛋白,如人类胰蛋白酶β2(TPSB2),组织蛋白酶G(CTSG),肥大细胞蛋白酶11(MCPT11),组氨酸脱羧酶(HDC),KIT(CD117)和白介素1受体样1(也称为ST-2或IL-33R)。
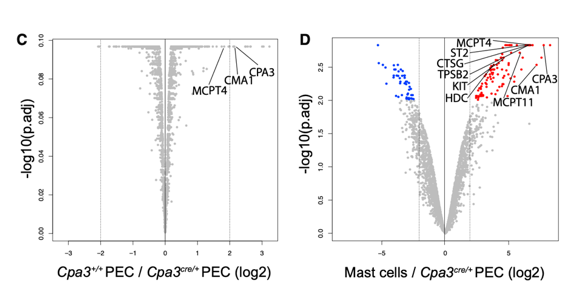
小鼠肥大细胞缺乏关键先天性传感器受体
接下来,作者比较了腹膜腔中纯化的肥大细胞和巨噬细胞的蛋白组学数据(肥大细胞中检测到4,620个蛋白质,巨噬细胞中检测到6,669个蛋白质,两种细胞共有3,914种蛋白质)。结合文献,作者进一步分析两种细胞中关键模式识别受体(Toll样受体,TLR)及其与先天免疫细胞功能相关的信号通路成分的表达。在巨噬细胞中可检测到几种不同类型的模式识别受体,但在肥大细胞中则无法检测到,这表明腹膜肥大细胞至少在稳定状态下不具有广泛的固有模式识别能力。
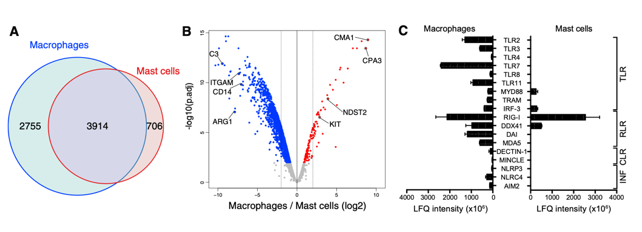
人和小鼠肥的肥大细胞蛋白特征比较分析
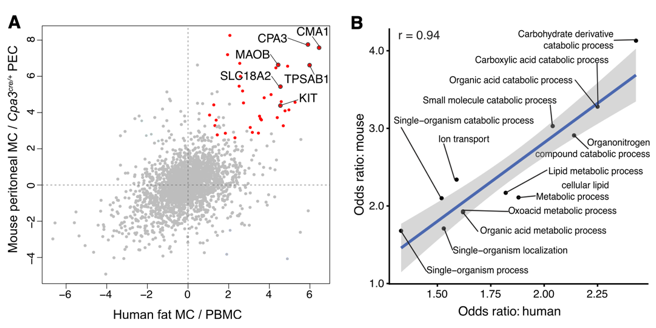
为比较人类和小鼠肥大细胞之间的相似性,我们将5,575个小鼠腹膜肥大细胞蛋白(纯化的腹膜肥大细胞与Cpa3cre / + PECs)与4,458个人脂肪肥大细胞蛋白(纯化的脂肪肥大细胞与PBMCs)进行对比分析。根据Ensembl注释,两个数据集中的406个蛋白质被鉴定为直系同源物;其中,与非肥大细胞相比,在小鼠和人类肥大细胞中36种蛋白质均显着过表达。为进一步表征人类(来自脂肪)和小鼠(来自PEC)肥大细胞之间的相似性,作者进行了基因本体论(GO)分析(类别生物学过程)。作者将人和小鼠肥大细胞中富集的GO条目进行散点图绘制,发现共有的GO项在各个物种之间显示出非常相似的优势比,而Pearson相关性的计算显示出接近完美的相关性(r = 0.94)。其中,碳水化合物和脂质的代谢途径被富集,表明这些代谢途径在肥大细胞中的作用。值得注意的是,肥大细胞需要脂质和碳水化合物来生成和维持蛋白聚糖颗粒。
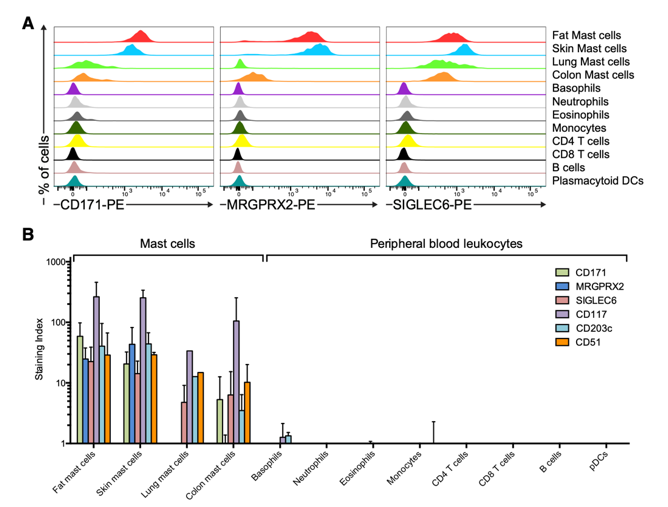
作者通过流式细胞术在4种不同来源人肥大细胞和其他PBMC细胞中测试了16种标志物的细胞表面表达(皮肤和脂肪仅包含结缔组织型肥大细胞,而肺和结肠组织既包含结缔组织型肥大细胞,也包含粘膜型肥大细胞)。CD171,MRGPRX2,SIGLEC6,CD117,CD203c和CD51在肥大细胞上表现出最强的阳性染色,而在PBMC子集上近乎检测不到。其中,MRGPRX2和CD171在皮肤和脂肪组织的结缔组织肥大细胞中呈阳性(而在肺部和结肠细胞中极少表达),表明该受体主要在结缔组织表达。此外,SIGLEC6在四种类型的肥大细胞中均呈阳性,表明SIGLEC6是人类通用的肥大细胞标记。
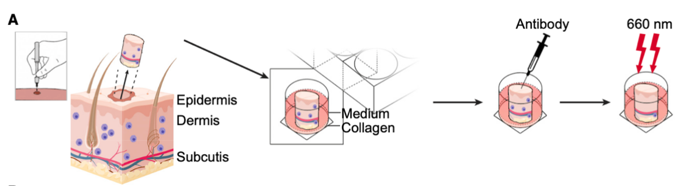
使用MRGPRX2特异性抗体的光免疫疗法可导致人体皮肤肥大细胞耗竭
近来,近红外光免疫疗法已引起肿瘤领域大众关注。该技术通过将光敏剂(例如IR700DX)偶联的单克隆抗体递送至肿瘤,然后利用近红外光照射激活细胞毒性、杀死肿瘤细胞。
为了探究我们能否利用新筛选的人肥大细胞特异性受体(MRGPRX2)结合金红外光免疫疗法在体外特异性清除人体组织中的肥大细胞,我们准备了穿刺活检皮肤组织:1)体外培养6小时后,向皮肤外植体皮下注射光敏剂偶联(anti-MRGPRX2-IR700DX)或对照(anti-MRGPRX2)抗体;2)第二天,将培养物暴露在660 nm的光下以激活光敏剂(IR700DX);3)照射后二十四小时后消化组织,并对细胞悬液进行CD45,CD117和FcεRI染色以检测肥大细胞和CD14来检测巨噬细胞。
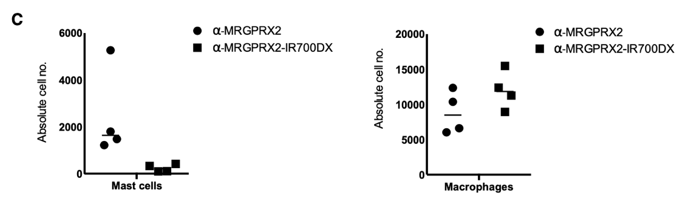
与注射对照抗体的皮肤样品相比,IR700DX标记的抗体的光激活消耗了70%至90%的人类肥大细胞,而巨噬细胞的数量没有减少,这些结果提示从人体皮肤组织中去除特定肥大细胞的可行性。
本文小结
作者为阐明主要肥大细胞功能的结构基础,通过定量蛋白组学技术分析了原代人和小鼠肥大细胞,发现肥大细胞特有的蛋白质组特征,其具独特的谱系。接着,作者比较了人与小鼠之间的蛋白质组数据,发现核心肥大细胞功能的进化保守性。除了与脱粒和蛋白聚糖生物合成相关的特定蛋白酶和蛋白质外,肥大细胞还表达可能与神经元和神经递质代谢相互作用相关的蛋白质。为了研究严重过敏性疾病中的靶向细胞消融,他们在人类皮肤活检中使用MRGPRX2消除肥大细胞。这些蛋白质组学分析表明,肥大细胞在免疫系统中可能具有独特的作用,成为未来神经性疾病的干预靶点。

