上一期我们介绍了细胞分选在单细胞测序中的适用场景,今天小编带大家继续了解常见的细胞分选方式及其应用。
一、 常见细胞分选类型
01
物理分选
细胞分选通常是指根据细胞本身特性把某种特定的细胞亚群从混合的细胞样品中分离出来,常见的物理分选方法即密度梯度离心法(Density gradient centrifugation),利用悬液中不同颗粒之间存在的沉降系数差,在一定离心力作用下,使颗粒各自以一定速度沉降,在密度梯度不同区域上形成区带,进而实现特定细胞的分离。
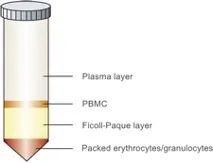
Ficoll和Percoll是常见的密度梯度离心分离剂。Ficoll是蔗糖的多聚体,中性,Ficoll密度梯度离心法是分离、纯化PBMC最常用的方法。Percoll的成分是硅化聚乙-烯吡-咯烷酮(polyvinyl pyrolidone, PVP),无毒无刺激,Percoll硅胶混颗粒悬液具有易成等渗、粘度低、无毒性、不引起细胞聚集等优点。由于Percoll在培养基中颗粒大小不等,其在离心过程中自然形成密度梯度,从而将不同密度的细胞分离出来。将1份10×PBS与9份percoll储存液混合,制成等渗Percoll悬液,此悬液被认为是100% Percoll悬液,密度为1.1294g/ml。Percoll稀释度与密度线性相关,实际生产中我们常可通过用1×PBS稀释100% Percoll悬液,进而获得适宜密度对进行细胞分离,获得目的细胞。
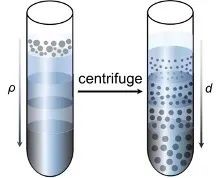
密度梯度离心分离细胞
物理分选具有操作相对简便、对细胞无毒、悬液PH中性或易调为中性等优点,但可以分选的细胞类型有限,同时由于细胞损失量较大,对悬液的起始细胞量要求较高,一般需要细胞量≥5×106才可以尝试操作,适用于分选体液类样本中的单核细胞分选、部分样本的预富集处理等。
02
磁珠分选
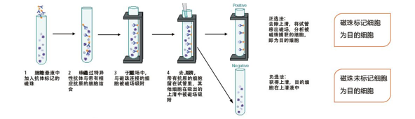
磁珠细胞分选(Magnet-Activated Cell Sorting ,MACS)发展于20世纪70年代,其主要原理是将有抗体结合的免疫磁珠与样品细胞进行孵育,随后表达有相应抗原的细胞就会特异性的结合在包被有抗体的免疫磁性微粒上,当体系缓慢的经过磁场时,带有磁珠的细胞就会滞留在磁铁上,而非目的细胞由于未结合磁珠仍存在于混合细胞悬液中,从而达到分离纯化细胞的目的。
磁珠法分选细胞时,根据目标细胞是否直接被磁珠捕获后分离获得,可将其分成正选和负选两种方法。正选是指目标细胞被磁性标记后,通过磁性分离直接分选出被捕获的目标细胞,也称为阳选。正选方法只需用一种抗体标记的磁珠便可获得纯度较高的目标细胞,操作简单直接,但最后洗脱获取的目标细胞上标记有磁珠,可能对细胞有一定激活作用,致使下游应用受到一定影响。相对的,负选则是将磁性标记于非目标细胞上,通过磁性分离去除非目标细胞,而收集的上清液则包含目标细胞,可被收集获取,也称为阴选。负选获得的目标细胞未被磁珠标记,无需去除磁珠,但为去除非目标细胞,需使用多种抗体标记的磁珠,成本相对较高。
MACS是一种相对高效简便的细胞分选方法,所需设备简单且操作简便,具有高灵敏度、高特异性、对目的细胞刺激较小等优点。基于分选过程对细胞的损耗,磁珠分选对悬液起始细胞量要求较高,需≥ 1×106个细胞才可以尝试,同时需要有配合磁极、吸附柱等工具进行操作。另外,当目标细胞群占比低于5%时,磁珠分选会有一定比例的非特异性,可能会有一些非目的细胞的富集。磁珠分选后,如果想确认分选结果中目标细胞的占比,仍需通过流式检测来鉴定分选效果。
03
流式分选
流式细胞仪(Flow cytometer)主要通过接受激光照射后液流内细胞的散射光信号和荧光信号反映细胞的物理化学特性,如细胞的大小、颗粒度以及抗原分子的表达情况等,可对细胞亚群的物理化学特性进行快速定量分析。流式分选(fluorescence-activated cell sorting,FACS)是指荧光驱动的细胞分选技术,即利用分选型流式细胞仪分选标记有荧光素偶联抗体的细胞样品,通过调节合适的电压、补偿等,同时结合荧光系统将目的细胞与非目的细胞区分开来。
分选型流式细胞仪通常由液流系统、光路系统、检测分析系统和分选系统4部分组成。分选功能是通过对鞘液流形成的含有细胞的带电液滴进行操作而实现,当充以不同电荷的含细胞的鞘液流经带有恒定电场的偏转板时,就根据自身所带的电荷性质产生偏差而落入各自的收集管中,不带电荷的液滴就进入废液槽中,从而实现细胞分选的目的。
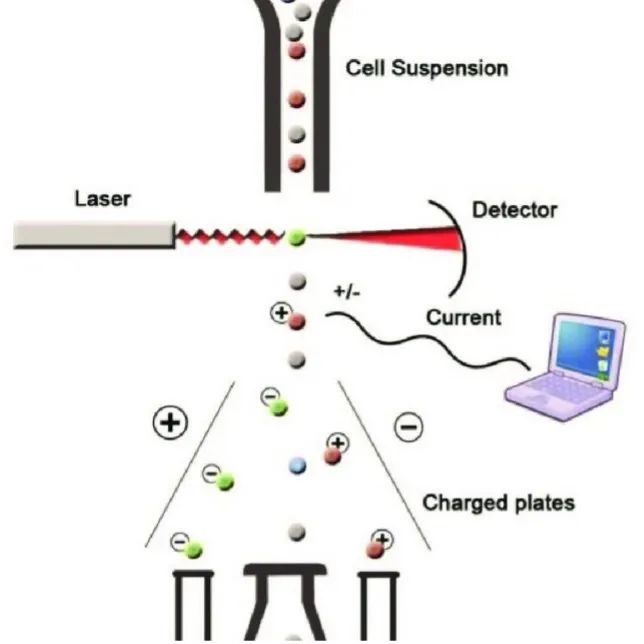
流式分选原理
流式细胞分选广泛适用于各种细胞类型,具有高分辨率,被认为是细胞分选的“金标准”,分选所得的细胞纯度高、回收率高、且操作环境为全封闭型,不易被污染。但流式分选方法需要专业的分选仪器,操作相对耗时;流式分选需要起始细胞量≧2×105个,分选过程中需要平衡分选时间,流速和电压,因此需要高水平的技术支持以及专业的操作人员;同时,由于流式分选对细胞刺激较大,分选压力会损伤细胞,因此对分选出的细胞活性有一定影响。
二、流式分选在单细胞测序中的应用优势
近年来,单细胞测序技术的快速发展帮助科研工作者们对每个单细胞进行分析,认识单个细胞间的异质性,深入了解包括复杂器官中不同细胞亚型的功能、胚胎发育早期的分化特征、干细胞发育和分化的分子机理、肿瘤免疫微环境的非均质性及癌细胞的亚群分类、神经元细胞分化过程的转录调控机制等以往群体样本研究中传统高通量测序方法难以攻克的领域。短短数年时间,单细胞测序便取得了飞速的发展以及瞩目的成果,在包括神经生物学、免疫学、胚胎发育、癌症、临床诊断等多个领域都有诸多应用。
单细胞样品的制备是单细胞测序分析的第一步,保证细胞的生物完整性是进行单细胞测序的必要条件,也是后续高质量测序数据的有力保障。高活性、无细胞碎片且均一的单细胞悬液可使测序结果在完整性、真实性、数据可重复性得到提升。随着单细胞研究的不断推进,现如今已有越来越多的单细胞研究在制备单细胞样本的时候会结合分选操作,利用细胞分选的方法富集目的细胞群体,缩小研究范围,对单细胞群体可进一步精细化解读。
最常见细胞分离的方法包括物理分选、MACS磁珠分选以及FACS流式细胞分选。
流式细胞分选通过适宜的荧光标记目的细胞,经荧光染色或标记的单细胞悬液被高压压入流动室内后,在鞘液的包裹和推动下,单列细胞以一定速度从流动室喷口喷出,通过相应荧光检测及充电,获得目的细胞,实现单细胞分离。根据细胞表面标记物表达,流式细胞可将表型与功能性输出(如细胞因子释放、转录因子的产生等)相关联,让单细胞测序研究目的性更强,研究更深入。
流式还可以同时进行多个Marker分选,正选负选同时进行。通过以给液滴充以不同的电量,从而调整液滴的偏转角度,实现多路分选。流式分选适用于分选无磁珠试剂的个性化目标细胞群,尤其适用于罕见细胞族群相关研究。在单细胞测序前,通过流式细胞分选富集稀有细胞,可大大增加实验数据真实性与可靠性,也可以极大地节约测序成本。同时,流式细胞分选在筛选目的细胞的同时,还可以过滤悬液中的死细胞和碎片杂质等,减少样本中无效细胞的比例,提高单细胞文库构建的成功率以及后续的数据质量,让单细胞测序更有深度与广度。
吉凯基因在单细胞测序悬液制备中拥有20年临床样本处理经验,能够高标准制备各种疑难样本的单细胞悬液,如钙化血管样本、腰椎间盘样本、穿刺样本等,并根据客户需求成功进行多例样本的特定类型细胞富集、稀有细胞富集、活细胞分选等,提供流式分选+单细胞测序一站式服务,化非特异为特异,为客户的科研保驾护航。
01
物理分选
细胞分选通常是指根据细胞本身特性把某种特定的细胞亚群从混合的细胞样品中分离出来,常见的物理分选方法即密度梯度离心法(Density gradient centrifugation),利用悬液中不同颗粒之间存在的沉降系数差,在一定离心力作用下,使颗粒各自以一定速度沉降,在密度梯度不同区域上形成区带,进而实现特定细胞的分离。
Ficoll和Percoll是常见的密度梯度离心分离剂。Ficoll是蔗糖的多聚体,中性,Ficoll密度梯度离心法是分离、纯化PBMC最常用的方法。Percoll的成分是硅化聚乙-烯吡-咯烷酮(polyvinyl pyrolidone, PVP),无毒无刺激,Percoll硅胶混颗粒悬液具有易成等渗、粘度低、无毒性、不引起细胞聚集等优点。由于Percoll在培养基中颗粒大小不等,其在离心过程中自然形成密度梯度,从而将不同密度的细胞分离出来。将1份10×PBS与9份percoll储存液混合,制成等渗Percoll悬液,此悬液被认为是100% Percoll悬液,密度为1.1294g/ml。Percoll稀释度与密度线性相关,实际生产中我们常可通过用1×PBS稀释100% Percoll悬液,进而获得适宜密度对进行细胞分离,获得目的细胞。

密度梯度离心分离细胞

Ficoll分离血液中的PBMC
物理分选具有操作相对简便、对细胞无毒、悬液PH中性或易调为中性等优点,但可以分选的细胞类型有限,同时由于细胞损失量较大,对悬液的起始细胞量要求较高,一般需要细胞量≥5×106才可以尝试操作,适用于分选体液类样本中的单核细胞分选、部分样本的预富集处理等。
02
磁珠分选
磁珠细胞分选(Magnet-Activated Cell Sorting ,MACS)发展于20世纪70年代,其主要原理是将有抗体结合的免疫磁珠与样品细胞进行孵育,随后表达有相应抗原的细胞就会特异性的结合在包被有抗体的免疫磁性微粒上,当体系缓慢的经过磁场时,带有磁珠的细胞就会滞留在磁铁上,而非目的细胞由于未结合磁珠仍存在于混合细胞悬液中,从而达到分离纯化细胞的目的。
磁珠法分选细胞时,根据目标细胞是否直接被磁珠捕获后分离获得,可将其分成正选和负选两种方法。正选是指目标细胞被磁性标记后,通过磁性分离直接分选出被捕获的目标细胞,也称为阳选。正选方法只需用一种抗体标记的磁珠便可获得纯度较高的目标细胞,操作简单直接,但最后洗脱获取的目标细胞上标记有磁珠,可能对细胞有一定激活作用,致使下游应用受到一定影响。相对的,负选则是将磁性标记于非目标细胞上,通过磁性分离去除非目标细胞,而收集的上清液则包含目标细胞,可被收集获取,也称为阴选。负选获得的目标细胞未被磁珠标记,无需去除磁珠,但为去除非目标细胞,需使用多种抗体标记的磁珠,成本相对较高。

磁珠法分选细胞
MACS是一种相对高效简便的细胞分选方法,所需设备简单且操作简便,具有高灵敏度、高特异性、对目的细胞刺激较小等优点。基于分选过程对细胞的损耗,磁珠分选对悬液起始细胞量要求较高,需≥ 1×106个细胞才可以尝试,同时需要有配合磁极、吸附柱等工具进行操作。另外,当目标细胞群占比低于5%时,磁珠分选会有一定比例的非特异性,可能会有一些非目的细胞的富集。磁珠分选后,如果想确认分选结果中目标细胞的占比,仍需通过流式检测来鉴定分选效果。
03
流式分选
流式细胞仪(Flow cytometer)主要通过接受激光照射后液流内细胞的散射光信号和荧光信号反映细胞的物理化学特性,如细胞的大小、颗粒度以及抗原分子的表达情况等,可对细胞亚群的物理化学特性进行快速定量分析。流式分选(fluorescence-activated cell sorting,FACS)是指荧光驱动的细胞分选技术,即利用分选型流式细胞仪分选标记有荧光素偶联抗体的细胞样品,通过调节合适的电压、补偿等,同时结合荧光系统将目的细胞与非目的细胞区分开来。
分选型流式细胞仪通常由液流系统、光路系统、检测分析系统和分选系统4部分组成。分选功能是通过对鞘液流形成的含有细胞的带电液滴进行操作而实现,当充以不同电荷的含细胞的鞘液流经带有恒定电场的偏转板时,就根据自身所带的电荷性质产生偏差而落入各自的收集管中,不带电荷的液滴就进入废液槽中,从而实现细胞分选的目的。

流式分选原理
流式细胞分选广泛适用于各种细胞类型,具有高分辨率,被认为是细胞分选的“金标准”,分选所得的细胞纯度高、回收率高、且操作环境为全封闭型,不易被污染。但流式分选方法需要专业的分选仪器,操作相对耗时;流式分选需要起始细胞量≧2×105个,分选过程中需要平衡分选时间,流速和电压,因此需要高水平的技术支持以及专业的操作人员;同时,由于流式分选对细胞刺激较大,分选压力会损伤细胞,因此对分选出的细胞活性有一定影响。
二、流式分选在单细胞测序中的应用优势
近年来,单细胞测序技术的快速发展帮助科研工作者们对每个单细胞进行分析,认识单个细胞间的异质性,深入了解包括复杂器官中不同细胞亚型的功能、胚胎发育早期的分化特征、干细胞发育和分化的分子机理、肿瘤免疫微环境的非均质性及癌细胞的亚群分类、神经元细胞分化过程的转录调控机制等以往群体样本研究中传统高通量测序方法难以攻克的领域。短短数年时间,单细胞测序便取得了飞速的发展以及瞩目的成果,在包括神经生物学、免疫学、胚胎发育、癌症、临床诊断等多个领域都有诸多应用。
单细胞样品的制备是单细胞测序分析的第一步,保证细胞的生物完整性是进行单细胞测序的必要条件,也是后续高质量测序数据的有力保障。高活性、无细胞碎片且均一的单细胞悬液可使测序结果在完整性、真实性、数据可重复性得到提升。随着单细胞研究的不断推进,现如今已有越来越多的单细胞研究在制备单细胞样本的时候会结合分选操作,利用细胞分选的方法富集目的细胞群体,缩小研究范围,对单细胞群体可进一步精细化解读。
最常见细胞分离的方法包括物理分选、MACS磁珠分选以及FACS流式细胞分选。
_ | 流式分选 | 磁珠分选 | 物理分选 |
| 适用范围 | 范围广 | 热门细胞类群 | 特定细胞类型 |
| 细胞损伤 | 压力损伤 | 无 | 无 |
| 细胞损失 | 低 | 低 | 较高 |
| 时间 | 1h以内 | 1h以内 | 1-2h |
| 特异性 | 高 | 较高 | 一般 |
| 其他鉴定 | 否 | 流式检测 | 流式检测 |
| 起始细胞量 | 2.00E+05 | 1.00E+06 | 2.00E+06 |
| 特殊仪器 | 流式分选仪器 | 磁极 | 无 |
流式细胞分选通过适宜的荧光标记目的细胞,经荧光染色或标记的单细胞悬液被高压压入流动室内后,在鞘液的包裹和推动下,单列细胞以一定速度从流动室喷口喷出,通过相应荧光检测及充电,获得目的细胞,实现单细胞分离。根据细胞表面标记物表达,流式细胞可将表型与功能性输出(如细胞因子释放、转录因子的产生等)相关联,让单细胞测序研究目的性更强,研究更深入。
流式还可以同时进行多个Marker分选,正选负选同时进行。通过以给液滴充以不同的电量,从而调整液滴的偏转角度,实现多路分选。流式分选适用于分选无磁珠试剂的个性化目标细胞群,尤其适用于罕见细胞族群相关研究。在单细胞测序前,通过流式细胞分选富集稀有细胞,可大大增加实验数据真实性与可靠性,也可以极大地节约测序成本。同时,流式细胞分选在筛选目的细胞的同时,还可以过滤悬液中的死细胞和碎片杂质等,减少样本中无效细胞的比例,提高单细胞文库构建的成功率以及后续的数据质量,让单细胞测序更有深度与广度。
吉凯基因在单细胞测序悬液制备中拥有20年临床样本处理经验,能够高标准制备各种疑难样本的单细胞悬液,如钙化血管样本、腰椎间盘样本、穿刺样本等,并根据客户需求成功进行多例样本的特定类型细胞富集、稀有细胞富集、活细胞分选等,提供流式分选+单细胞测序一站式服务,化非特异为特异,为客户的科研保驾护航。
