肠道是最大的免疫器官
近年来,针对肠道微生物影响宿主免疫的报导愈来愈多。然而,肠道微生物的影响机制,尤其是针对病毒感染的免疫机制至今仍知之甚少。近期,来自美国华盛顿大学的研究人员在Cell 上发表题为The Intestinal Microbiome Restricts Alphavirus Infection and Dissemination through a Bile Acid-Type I IFN Signaling Axis的文章,该研究利用微生物组、代谢组、单细胞转录组等技术揭示了肠道菌群如何通过I型干扰素途径抑制甲病毒感染。

主要研究结果:
1. 肠道菌群能够抑制病毒感染
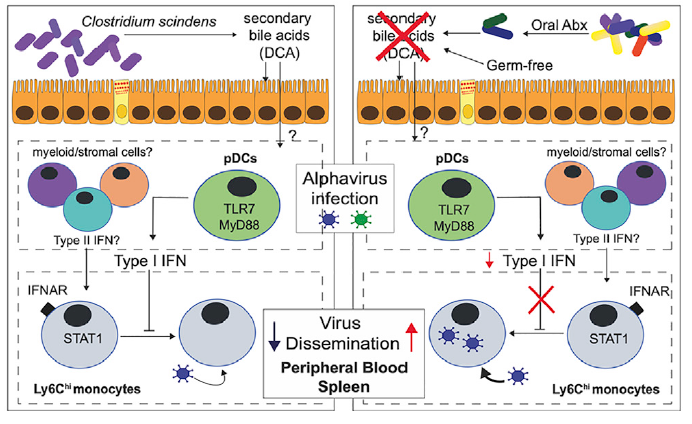
基孔肯雅病毒(Chikungunya virus,简称CHIKA)是一类蚊虫传播的甲病毒,作者通过给小鼠口服抗生素清除小鼠肠道菌群后,再皮下注射CHIKV后发现:清除菌群的小鼠的CHIKV荷载量远远高于对照小鼠。作为对照,作者将对照小鼠的粪便通过粪菌移植转移到清除菌群小鼠后,CHIKA感染水平又回到了正常水平。这些结果说明肠道菌群的存在有助于抑制CHIKA感染。
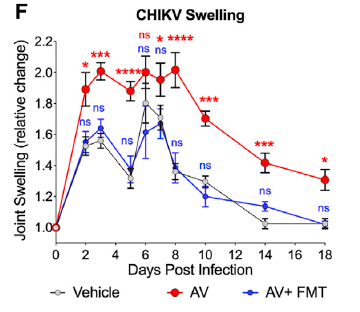
2. 利用单细胞转录组测序揭示关键分子机制
研究发现,在清除肠道菌群的小鼠中,病毒主要富集在外周血液白细胞中。通过流式细胞分选,发现CD11b+CD115+Ly6G– 单核细胞的病毒荷载量最高。接下来,作者在清除小鼠菌群的同时清除Ly6Chi 单核细胞,发现其病毒血症程度与对照小鼠类似,远低于单单清除菌群的小鼠。这些结果说明,单核细胞在肠道菌群抗病毒的过程中起到重要作用。因此,作者通过单细胞测序技术,重点关注单核细胞的细胞亚群后,发现清除肠道菌群可以有效降低外周血液单核细胞I型干扰素刺激基因(ISG)的诱导水平,从而增加CHIKA的感染效率。
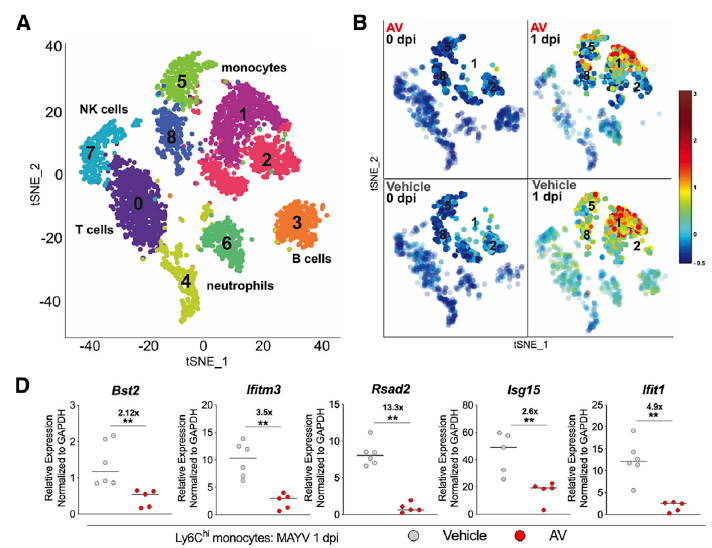
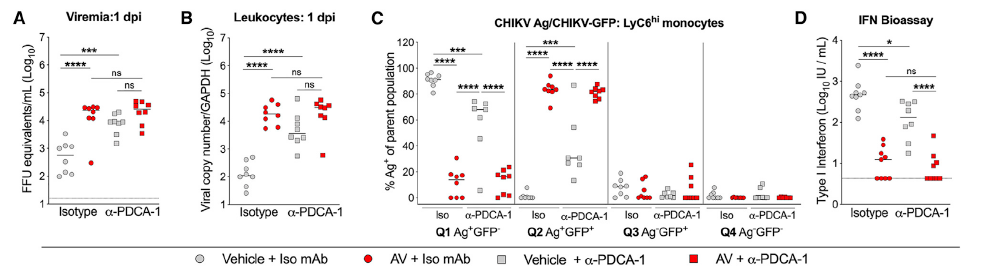
此外,有报导称ISG的表达受到来自pDCs的I型干扰素信号调控。为了证实这一假说,作者通过anti-PDCA-1 中和抗体清除小鼠体内的pDCs后发现CHIKV荷载量和病毒血症严重程度都显著提高,而I型干扰素水平却明显降低;而在清除肠道菌群的小鼠中同时清除pDCs时,它们的病毒荷载量没有明显的差异。该结果证实了单核细胞受到肠道菌群的调控是通过pDCs介导的。
3. 肠道微生物中的Clostridial Bacterium通过次级胆汁酸介导调控干扰素信号通路
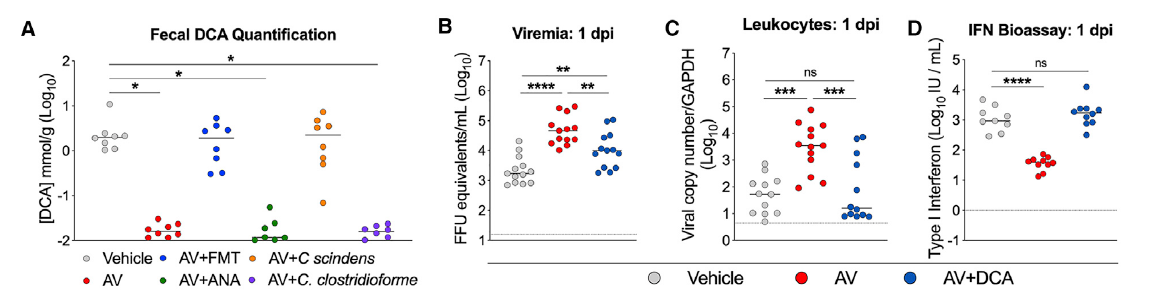
作者在研究干预肠道菌群是否可以改善CHIKV的感染的过程中发现,给菌群清除小鼠提供正常粪便,可以有效降低CHIKV的感染,而提供无氧菌群,则无法产生此保护功能。在比较了这两种粪菌移植后的菌群组成差异后,移植正常粪便后的小鼠中含有大量的C. bacterium。当直接在菌群清除小鼠中移植这种菌后,小鼠抗病毒能力显著上升。在菌群代谢物层面,次级胆汁酸是C. bacterium产生的主要代谢物。给菌群清除小鼠口服次级胆汁酸,同样也可以达到降低CHIKV感染的效果。
以上研究结果系统阐明了基于“次级胆汁酸-pDCs-I型干扰素-Ly6C单核细胞”的肠-免疫轴调控途径,为揭开肠道微生物免疫机制的神秘面纱提供了关键信息。
编者按:
基于肠-靶轴的多组学系统生物学研究是深入揭示肠道微生物功能的重要研究手段。其中,免疫系统作为一个全局性的系统,它与各种疾病与健康水平都息息相关。因此,肠-免疫轴的研究正如火如荼地展开。
然而,由于免疫细胞的种类非常复杂,传统的转录组、蛋白质组等技术手段很难精确表征免疫系统的响应机制。而单细胞转录组测序不仅可以区分不同样本的免疫细胞亚型比例差异,也可以检测特定细胞亚型中的差异表达基因。当结合其它肠道微生物研究常用的组学手段,如扩增子测序,宏基因组,代谢组等,单细胞多组学可以帮助研究者们更好地描绘肠道微生物介导的免疫调控机制。
