阿尔茨海默病(AD)是最常见的痴呆类型,其病理特征包括β-淀粉样蛋白沉积、神经纤维缠结和神经炎症,但其发病分子机制尚不明确,且目前针对AD的治疗手段仍十分有限。蛋白质表达变化比遗传或转录组改变更能直接反映病理状态,因而蛋白质组学技术可为解析AD发病机制提供更新的视角。
2025年9月25日,美国西奈山伊坎医学院张斌团队等在Cell期刊上发表了题为:Multiscale Proteomic Modeling Reveals Protein Networks Driving Alzheimer's Disease Pathogenesis的研究论文,该研究通过整合来自AD易感脑区——海马旁回(PHG)的大规模匹配蛋白质组和遗传数据,构建了多尺度AD蛋白质组网络模型。首次系统揭示了AD的蛋白质调控网络和关键驱动蛋白,为开发新一代AD治疗策略奠定了重要基础。

【技术路线】
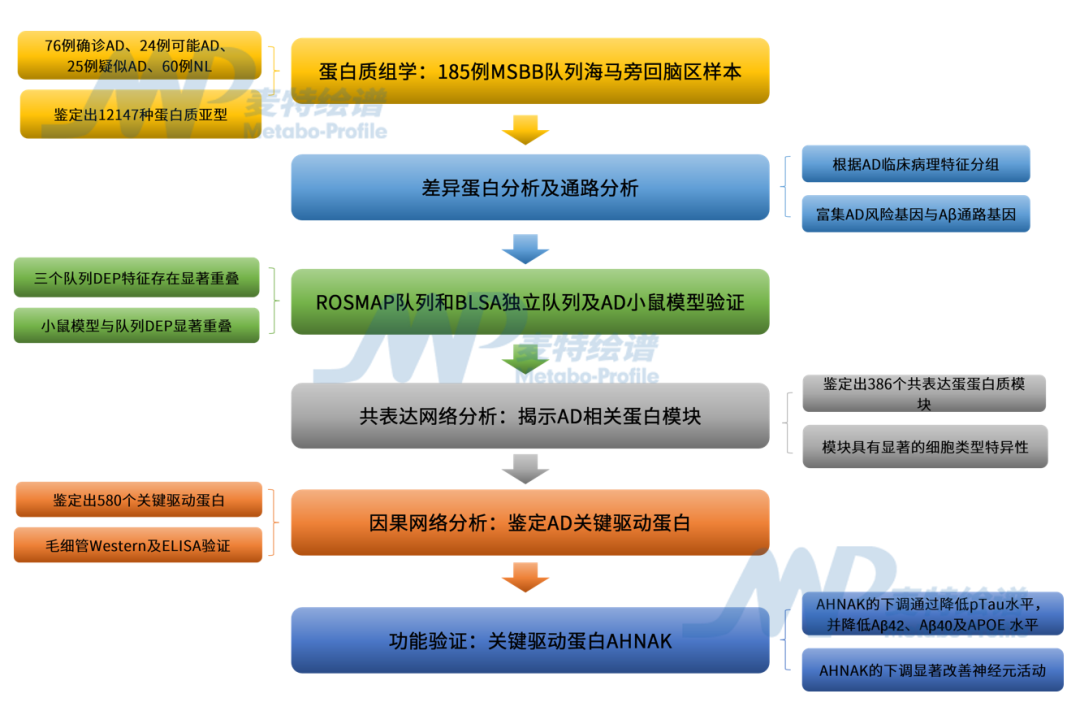
【研究结论】
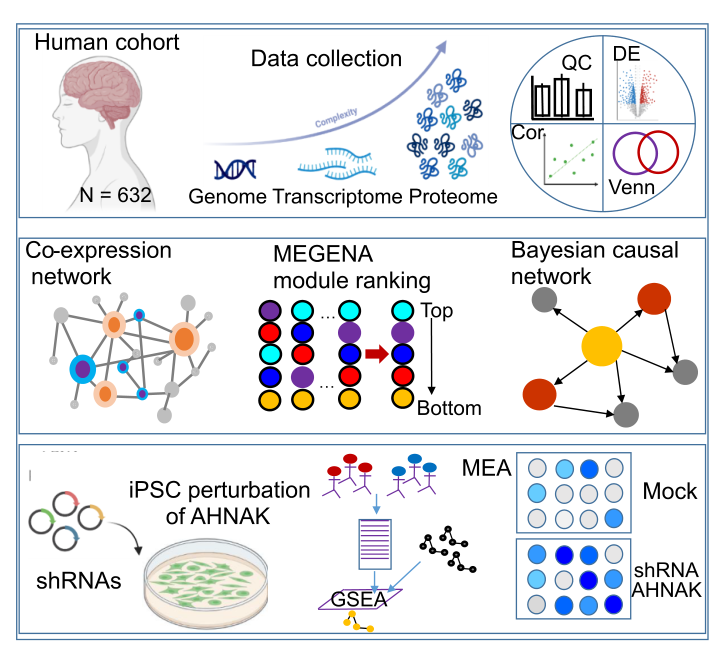
一、研究设计与蛋白质组队列构建
为解析AD易感脑区的蛋白质组变化,对来自西奈山/JJ Peters VA医疗中心脑库(MSBB)的198例死后AD、MCI及正常对照(NL)脑组织的海马旁回(PHG, AD易感关键区域)进行蛋白质组学分析,经质量控制(QC)后保留185例样本(76例确诊AD、24例可能AD、25例疑似AD、60例NL),共鉴定出12147种独特蛋白质亚型。
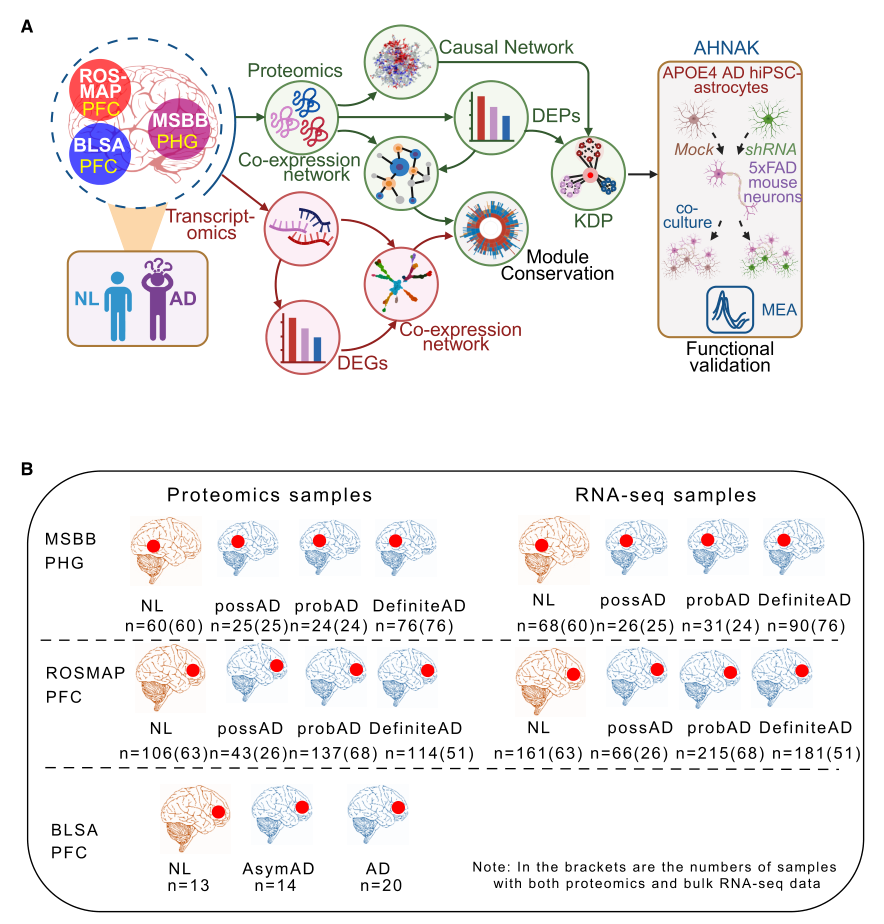
图1. 本研究计算与实验工作流程示意图
二、AD相关差异蛋白的鉴定
基于Braak分期、临床痴呆评分等AD特征将受试者按疾病严重程度分为“正常-中度-重度” 三组,通过差异分析发现:在重度AD与健康对照比较中鉴定出1,000多个差异表达蛋白,其中70%以上在AD组上调;而中度AD与对照间差异很小。功能富集分析显示,下调DEPs主要富集于神经元与突触功能相关通路,上调DEPs富集于免疫反应(小胶质细胞、星形胶质细胞激活)相关通路,且这些DEPs均显著富集已知的AD风险基因与Aβ通路基因。
进一步比较发现,基于认知评估和病理诊断的差异蛋白虽有重叠,但各有独特部分。此外,APOE基因型(AD主要风险因素)分析显示,携带APOE4的AD患者较对照组人群存在大量差异蛋白且AHNAK等蛋白表达随疾病进展呈递增趋势,提示APOE4可能通过加剧蛋白质组异常促进AD进展。性别分层分析揭示了显著的性别特异性:虽然男女患者存在共同的差异蛋白,但各有大量特有蛋白,表明AD相关的蛋白质组变化具有明显的性别差异。
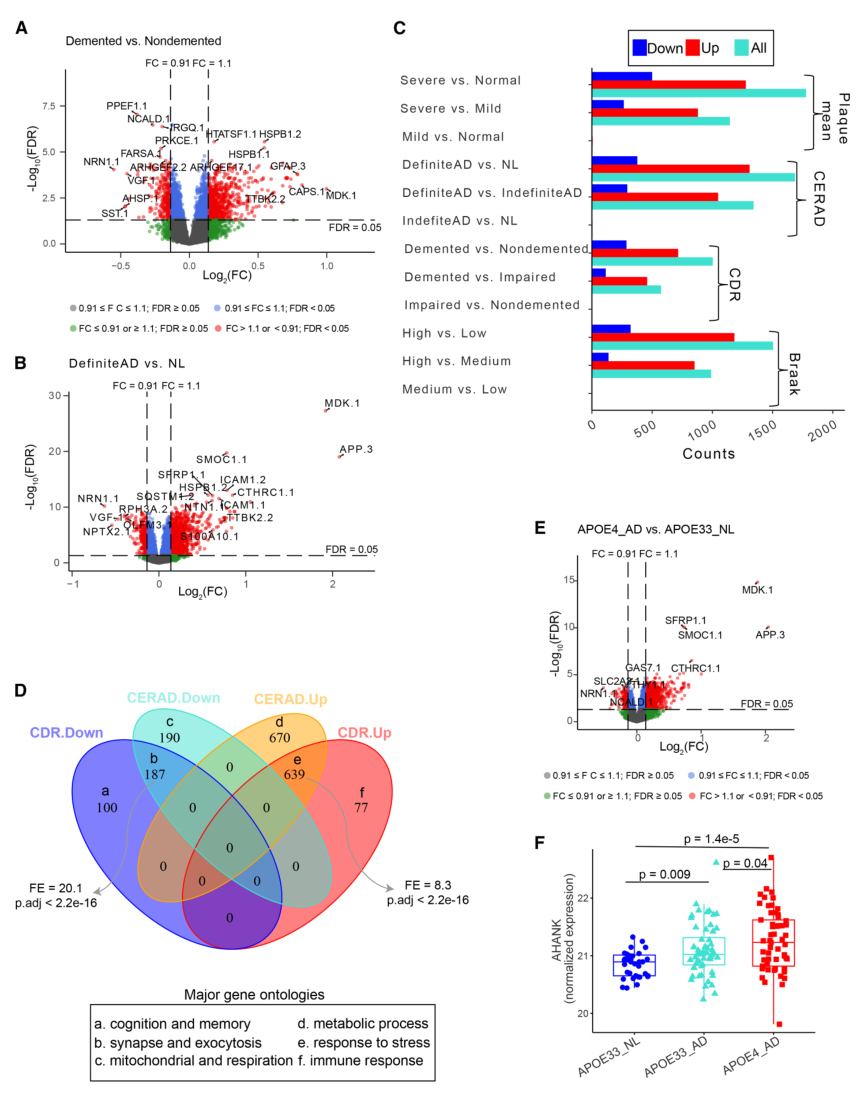
图2. MSBB队列中DEP分析结果
三、AD差异蛋白特征在独立队列与AD小鼠模型中验证
为验证上述发现,分别在2个独立队列(ROSMAP、BLSA)及AD小鼠模型中进行验证。结果显示:三个队列的DEP特征存在显著重叠。另外,在6月龄5xFAD小鼠(记忆功能开始衰退的阶段)中,其大脑DEPs与MSBB队列的DEPs显著重叠。同时还发现,MSBB海马旁回的DEPs与对应的差异表达基因(DEGs)高度一致:48.2%的上调DEPs、79.2%的下调DEPs在mRNA水平也呈现一致的变化趋势,且这些DEP在MSBB和ROSMAP队列中蛋白水平与mRNA水平显著相关。这些结果表明,该研究鉴定的AD相关蛋白质组特征具有跨脑区、跨物种的稳定性,且与转录组结果的变化高度一致。
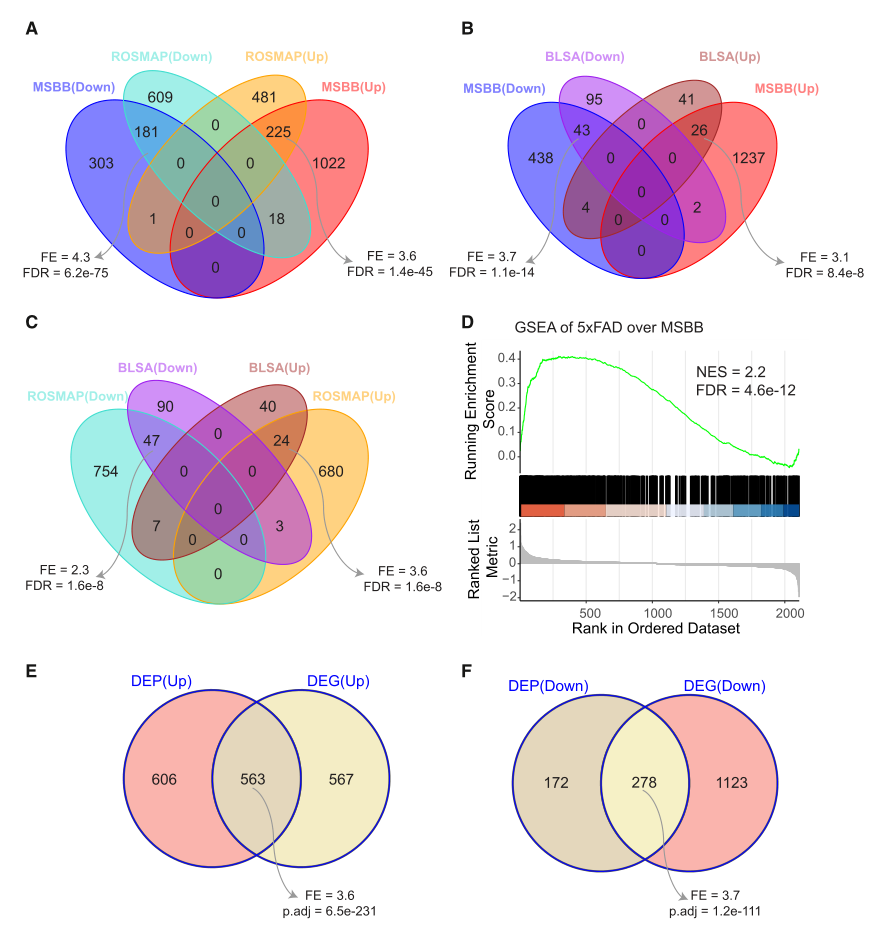
图3. ROSMAP和BLSA队列验证MSBB队列DEP特征
四、蛋白质共表达网络分析揭示AD相关蛋白模块
采用多尺度嵌入基因共表达网络分析(MEGENA),从185例样本的蛋白质组数据中构建共表达网络,鉴定出386个共表达蛋蛋白质模块。且这些模块具有显著的细胞类型特异性——下调模块富集神经元标志物,功能上与突触信号、认知相关;上调模块富集星形胶质细胞或小胶质细胞标志物,功能上与免疫反应、代谢过程相关。其中排名最高的M3(上调模块)模块捕获了下调神经元蛋白与激活的星形胶质细胞和小胶质细胞蛋白之间的相互作用网络;同时,通过单细胞RNA测序(snRNA-seq)数据验证发现,M3模块中星形胶质细胞蛋白与小胶质细胞蛋白存在大量显著相关性,这些结果揭示了通过蛋白质子网络M3实现的神经元、星形胶质细胞和小胶质细胞之间的复杂相互作用。
此外,模块保守性分析显示,分别有38.3%、12.2%和10.4%的模块在ROSMAP前额叶蛋白质网络、MSBB海马旁回基因网络和ROSMAP前额叶基因网络中保守。同时,还鉴定了10个海马旁回特异性蛋白质模块,这些模块在其他三个网络中均不保守。
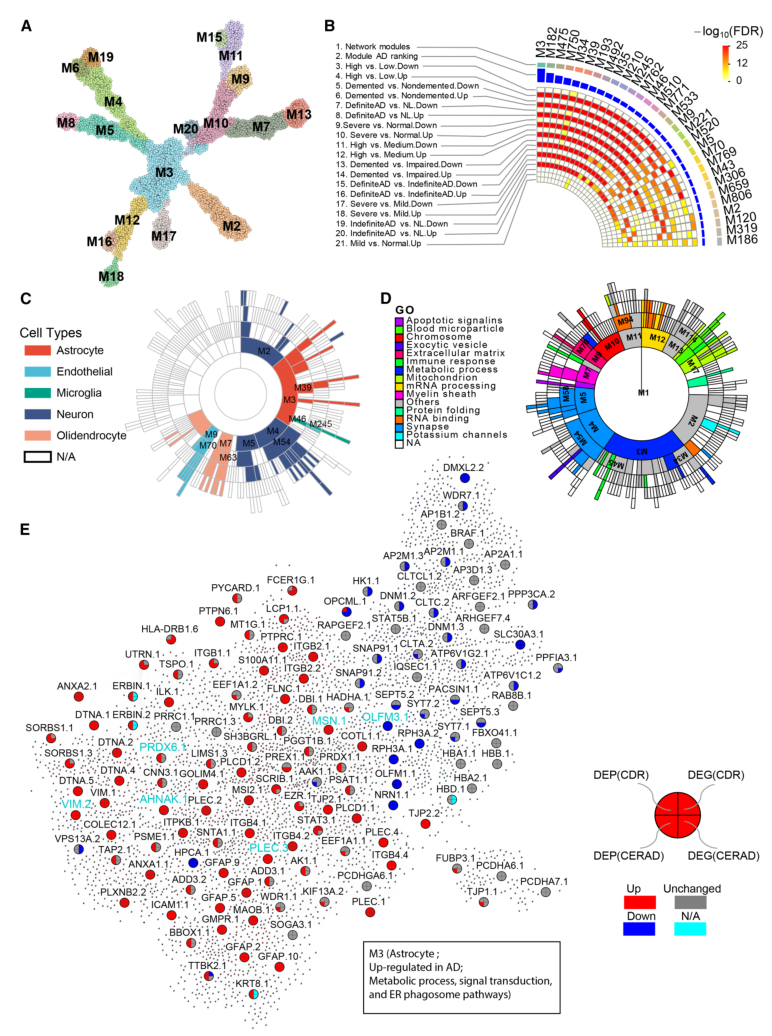
图4. MSBB队列PHG蛋白质组共表达网络分析
五、因果网络分析鉴定AD关键驱动蛋白
利用海马旁回蛋白质组数据与匹配的遗传数据(SNP),构建全局贝叶斯因果网络分析,通过关键驱动分析(KDA)鉴定出580个关键驱动蛋白(KDPs),对应471个基因。这些KDPs中,既有已知AD相关蛋白(如MSN、PRDX6,MSN为ERM复合物成分,参与胶质细胞代谢;PRDX6可抑制神经发生、减轻氧化损伤),也有高达72%的KDP在AD研究中极少被关注,其中AHNAK、RPH3A等11个KDPs位列前30名,且105个KDPs此前未在AD中研究;这表明预测结果不仅包含了已知AD相关靶点,更揭示了大量潜在的新靶点。
为验证KDPs的表达模式,通过定量毛细管Western或ELISA在相同样本的海马旁回中验证了7个top KDPs(MSN、PRDX6、VIM、AHNAK、RPH3A、OLFM3、NRN1),结果显示:除NRN1下调未达统计学显著性外,其余6个KDPs的表达变化均与蛋白质组分析结果一致。
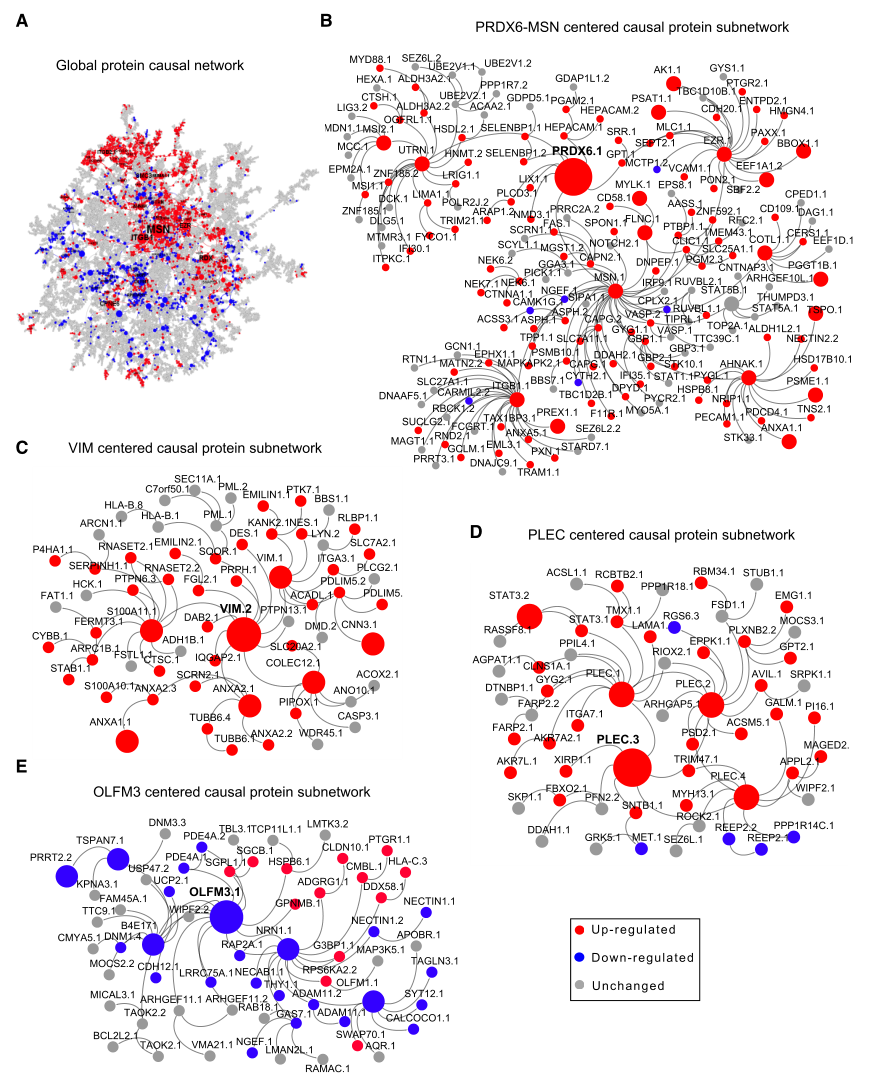
图5. 贝叶斯因果网络分析预测AD关键驱动蛋白
六、下调AHNAK可改善神经元活性
由于AHNAK是top5 KDPs中研究最少的蛋白,且在AD中显著上调、是星形胶质细胞模块的核心基因,进而选择AHNAK进行功能验证。通过snRNA-seq确认AHNAK主要在星形胶质细胞中表达,随后在APOE4纯合子(APOE44)AD 患者来源的人类诱导多能干细胞(iPSC)系中,通过shRNA下调AHNAK表达。功能实验结果显示:AHNAK下调可显著降低星形胶质细胞中pTau水平,并降低Aβ42、Aβ40及APOE水平。且与AHNAK敲低的星形胶质细胞共培养时,神经元的电活动(尖峰放电、爆发活动)显著改善,同时共培养系统中的pTau水平也一致降低。这表明,AHNAK的下调通过降低pTau水平等机制,对神经元活动和功能维持产生保护作用。
进一步的GSEA分析发现,AHNAK下调诱导的蛋白变化(涉及代谢、MAPK信号、炎症反应和脂质代谢等与AD相关的通路)显著富集于AHNAK中心的蛋白质网络邻域,证实AHNAK通过调控特定蛋白网络影响AD病理进程。
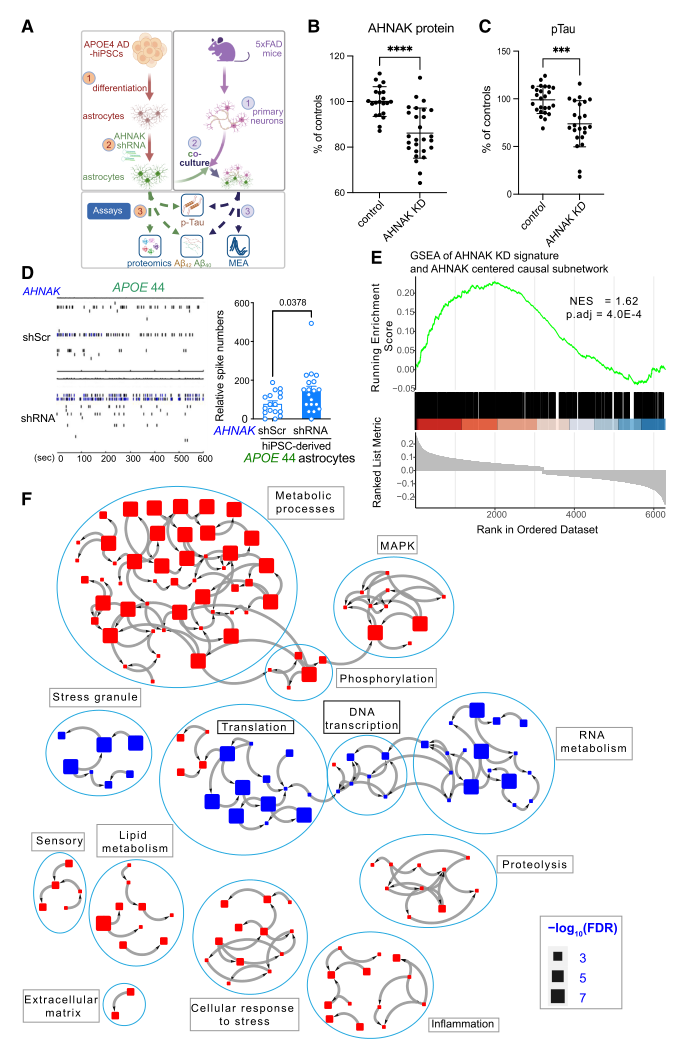
图6. AHNAK蛋白功能验证
【研究小结】
本研究聚焦于MSBB和ROSMAP两大AD队列,针对AD易感脑区:海马旁回(PHG)展开蛋白质组分析并进行多尺度蛋白质组网络建模。通过整合蛋白质共表达网络与贝叶斯因果网络分析方法,成功捕捉到神经元-小胶质细胞-星形胶质细胞相互作用的AD相关子网络。同时,鉴定出关键驱动蛋白AHNAK,AHNAK的下调降低pTau水平,并显著改善神经元活动。本研究为AD分子机制解析和新一代AD治疗策略开发提供了重要基础。
【参考文献】
Multiscale Proteomic Modeling Reveals Protein Networks Driving Alzheimer's Disease Pathogenesis. Cell. 2025
【绘谱帮你测】
麦特绘谱质谱平台拥有多年技术沉淀和升级,建立了独具特色的先进的蛋白质组学技术服务,涵盖Olink靶向蛋白质组、Astral-DIA蛋白质组、Astral深度血液蛋白质组、宏蛋白质组以及4D蛋白质组、TMT标记定量蛋白质组、DIA非标记定量蛋白质组、PRM靶向蛋白质组、修饰蛋白质组等全方位的产品,助力广大科研工作者科研更上一层楼!麦特绘谱已为数百家三甲医院、科研院所和企业提供多组学一站式整体解决方案,协助客户与合作伙伴发表SCI文章600+篇,累计影响因子6000+,平均IF>10,涵盖Cell, Science, Nature, Cancer Cell, Signal Transduction and Targeted Therapy, Nature Biotechnology, Cell Metabolism等权威期刊。
